Какви железни съединения са разтворими във вода. Химични и физични свойства на желязото
Изсипете 5-6 капки киселини в четири епруветки: 2N разтвор на HCl, 2N H2S04 разтвор, концентриран H2S04, 2N азотен разтвор. Във всяка епруветка добавете парче желязна стружка (или кламер). Загрейте епруветката с концентрирана сярна киселина. След това добавете към всички разтвори по една капка 0,01 N разтвор на калиев или амониев тиоцианат (KCNS или NH 4 CNS), които образуват Fe (CNS) 3 сол, която е интензивно оцветена в червено, с железни (III) йони. В кои киселини се образуват Fe 3+ йони?
В тези киселини, при които разтворът не е оцветен в червено, Fe 2+ йони се образуват при разтваряне на желязо.
За да добавите и изравните реакциите на разтваряне на желязо в различни киселини и посочете във всяка от тях окислителя:
а) Fe + HCl ® H 2 + ........
б) Fe + H 2 SO 4 (разлагане) ® H 2 + ........
в) Fe + H 2 SO 4 (конц) ® SO 2 + H 2 O + ........
г) Fe + HNO 3 (разлагане) ® NO + H 2 O + .......
Опит 2. Получаване на железен (II) хидроксид и изследване на неговите свойства.
Солите на желязо (II) поради частично окисляване във въздуха винаги съдържат железни (III) йони. Следователно, за да изучите свойствата на желязото (II), трябва да вземете кристалната сол на Мора, най-устойчива на окисляване / (NH 4) 2 SO 4 × Fe (SO 4) × 6H 2 O / и да приготвите пресен разтвор за всеки експеримент, като поставите няколко кристала в 5 -6 капки вода.
Изсипете 2 капки прясно приготвен разтвор на сол на Мох в три епруветки и добавете на капки 2 N алкален разтвор (NaOH) до получаване на зеленикаво-сива утайка от Fe (OH) 2. В една от епруветките с утайката се добавя 2N разтвор на солна киселина, докато се разтвори. Какви свойства (кисели или основни) проявява железен (II) хидроксид? Оставете пелетата във втората тръба във въздуха за няколко минути, като периодично разклащате тръбата. В третата епруветка се добавят 2-3 капки 3% разтвор на водороден пероксид (H 2 O 2). Обърнете внимание на промяната на цвета на утайката от зеленикаво до кафяво във втората и третата епруветка поради образуването на железен (III) хидроксид. Кога окисляването се случи по-бързо? Напишете уравненията на всички реакции: а) получаване на железен (II) хидроксид; б) разтваряне на утайката Fe (OH) 2 в солна киселина; в) окисляване на Fe (OH) 2 в Fe (OH) 3 с атмосферен кислород с участието на вода; г) окисляване на Fe (OH) 2 с водороден пероксид.
Опит 3. Редуциращите свойства на желязо (II) в кисела среда.
Поставете в епруветка 3 капки разтвор на калиев перманганат (KMnO 4) и 2 капки 2N разтвор на сярна киселина. Към разтвора се добавят няколко кристала от Морова сол. Защо възниква избелване? Какво е редуциращият агент в тази реакция? Добавете уравнението на реакцията:
KMnO 4 + H 2 SO 4 + FeSO 4 ® MnSO 4 + K 2 SO 4 + H 2 O + .....
Опит 4. Получаване на железен (III) хидроксид и изследване на неговите свойства.
В 2 епруветки добавете 2 капки разтвор на желязна (III) сол (FeCl 3 или Fe 2 (SO 4) 3) и на капки разтвор на 2N NaOH, докато утайката се утаи (маркирайте цвета). Изсипете 5-6 капки 2N разтвор на HCl или H2SO4 в една епруветка, а същото количество 2 капки 2N разтвор на NaOH в друга. Къде се е разтворила утайката? Какви свойства (основни или амфотерни) има железен (III) хидроксид? Напишете уравненията за реакцията.
Опит 5. Окислителни свойства на желязото (III).
В епруветка с 3 капки разтвор на желязна (III) сол добавете 1-2 капки разтвор на калиев йодид (KI). Обърнете внимание на промяната на цвета на разтвора. Какви свойства проявява йонът Fe 3+? Напишете уравнението на реакцията, като се има предвид, че един от реакционните продукти е I2.
Опит 6. Хидролизата на соли на желязо (II) и желязо (III)
Поставете две ленти от универсалния индикатор върху стъклен предмет и нанесете по 1 капка разтвори на сол на Мор и железен (III) хлорид (отделно). Определете pH на разтворите на тези соли. Напишете уравненията (йонни) на реакциите на хидролиза на тези соли на първия етап. Коя сол се хидролизира в по-голяма степен? Кой хидроксид на желязо (II) или желязо (III) има по-основни свойства?
Опит 7. Качествени реакции на йони на желязо.
а) Реакция на железни (II) йони
Към 2-3 капки разтвор на Мора сол добавете 1 капка калиев хексацианоферрат (III) (К 3). Маркирайте цвета на утайката на KFe. Напишете уравнението на реакцията.
б) Реакция на железен (III) йон
Към 2-3 капки разтвор на железен (III) хлорид се добавя 1 капка разреден разтвор на калиев тиоцианат (KCNS) или амоний (NH 4 CNS). Маркирайте цвета на получения разтвор на желязо (III) роданид. Напишете уравнението на реакцията.
Опит 8. Получаване на хидроксиди на кобалт (II), никел (II) и изследване на техните свойства.
а) Пипетирайте 2-3 капки разтвор на кобалтова сол (CoCl 2) в две епруветки (маркирайте цвета) и добавете алкален разтвор във всяка капка. Първо се появява синя утайка от основната сол на Co (OH) Cl, която след това променя цвета си в розов поради образуването на кобалт (II) хидроксид (Co (OH) 2). Напишете реакционните уравнения за образуването на кобалт (II) хидроксид на етапи. Разклатете гранулата в една тръба и я оставете на въздуха за няколко минути. Към утайката във втората епруветка се добавят 2-3 капки 3% разтвор на водороден пероксид. Обърнете внимание на промяната в цвета на утайката. Напишете уравненията за окислението на Co (OH) 2 до Co (OH) 3 с атмосферен кислород и водороден пероксид (H 2 O 2). Кога окисляването е по-бързо?
б) В 2-3 епруветки добавете 2-3 капки разтвор на никелова сол (цвят) и капка по капка добавете алкален разтвор, докато утайката на утайките от никел (II) хидроксид (цвят). Опитайте се да окислите получения хидроксид с различни окислители. За целта оставете утайката в първата епруветка на въздух, добавете 2-3 капки 3% разтвор на Н 2 О 2 във втората епруветка и 1 капка бром вода (Br 2 + H 2 O) във третата епруветка. В коя епруветка се наблюдава цветът на наблюдаваната утайка, т.е. е окисляване на Ni (OH) 2 до Ni (OH) 3? За да добавите реакционните уравнения за получаване на никелов (II) хидроксид и никелов (III) хидроксид:
NiSO 4 + NaOH ® Na 2 SO 4 + .....
Ni (OH) 2 + Br 2 + NaOH ® NaBr + H 2 O + ...
Въпроси за сигурност.
1 .. Напишете електронните формули на атомите на желязо, кобалт, никел.
2. Какви степени на окисляване са характерни за атомите на елементи от желязо, кобалт, никел?
3. Кое от веществата Fe (OH) 2, Co (OH) 2 или Ni (OH) 2 е по-силно редуциращо средство? Заключението се прави въз основа на реакциите на тези хидроксиди с атмосферен кислород, H 2 O 2 и Br 2. (силата на окислителя се увеличава в серия O 2 ® H 2 O 2 ® Br 2).
4. Напишете уравненията на реакцията, чрез които е възможно да се прави разлика между Fe 2+ и Fe 3+ йони.
5. Как да получите железна (II) сол от метално желязо? Напишете уравнението на реакцията.
6. Как да получите желязна (III) сол от метално желязо? Напишете уравнението на реакцията.
7. Коя желязна сол е по-хидролизирана: FeCl 2 или FeCl 3? Напишете уравненията на реакциите на хидролиза. Каква е реакцията на разтворите на тези соли?
8. Как да преобразуваме желязната (II) сол в желязната (III) сол? Дайте пример за такъв преход.
9. Как да преобразуваме желязната (III) сол в желязната (II) сол? Дайте пример за такава реакция.
10. Могат ли да съществуват едновременно: а) Fe (OH) 2 и H 2 O 2?
б) Ni (OH) 2 и Н202? Защо? Ако има реакция, тогава я напишете.
11. Могат ли да съществуват едновременно: a) Ni (OH) 2 и Br 2?
б) FeCl 3 и KI? Ако има реакции, тогава ги напишете.
12. Какъв хидроксид Fe (OH) 2 или Ni (OH) 2 може да се окисли от атмосферен кислород? Ако реакцията е включена, напишете я.
13. На чиста повърхност на сплавта се нанася 1-2 капки концентрирана киселина и след 2-3 минути. филтърна хартия, навлажнена с KCNS разтвор, се прилага към капката. На хартията се появи червено петно. Какъв метал присъства в сплавта? Напишете реакция.
14. Как могат да се получат Co (OH) 3 и Ni (OH) 3 в лабораторията? Напишете уравненията за реакцията.
15. Когато хлорът е наситен с железен (III) хидроксид, суспендиран в разтвор на калиев хидроксид, се образува калиев ферат. Напишете уравнението на реакцията.
16. Напишете уравненията за реакцията: а) между бариев ферат и концентриран солна киселина; б) между калиев ферат и калиев йодид.
17. Какво се случва, когато разтвор на натриев карбонат се добави а) към разтвор на железен (II) сулфат; б) до разтвор на железен (III) сулфат? Какво причинява разликата в естеството на образуваните продукти? Напишете уравненията за реакцията.
18. Напишете уравненията на реакцията, които могат да възникнат под действието на разтвор на натриев сулфид а) върху разтвор на желязо (II) хлорид: б) върху разтвор на железен (III) хлорид. Може ли утайката да се разтвори в излишна солна киселина?
19. Какви съединения образуват желязо, кобалт, никел с въглероден оксид? При какви условия ги получават?
20. Дайте примери за реакции за производството на ферити. Какво се случва при добавяне на излишна вода към натриев ферит. Напишете уравненията за реакцията.
ХИМИЯ НА НЕМЕТАЛНИТЕ
Борът (В) и алуминият са включени в основната подгрупа на група III на периодичната система. Във външния електронен слой от атоми има три електрона:
Тъй като на предпоследното ниво на бор има само два електрона, неговите свойства рязко се различават от свойствата на други елементи от подгрупата - това е единственият неметал от III А подгрупа. Въпреки че формално борът има окислително състояние +3 в оксиди и халиди, йонът В +3 не е известен. Три sp2-хибридни облака на възбуден бомен атом участват в образуването на ковалентни връзки с неметали, следователно борните съединения със състояние на окисляване +3 имат плоска - триъгълна структура.
В съединенията с метали - бориди - борът е акцептор на електрон: Mg 3 B 2, AlB и др.
При обикновени условия просто вещество е бор - твърдо вещество (t PL \u003d 2075 ° C). Кристалната структура на бора е специална. Не е характерно нито за металите, нито за неметалите. Той реализира по-голям брой връзки (\u003e 4), чийто характер не е нито метален, нито обикновен ковалент. Боровият кристал се състои от икозаедри - правилни триъгълници с 12 върха. При обикновени температури борът е много инертен. При високи температури тя става активна, взаимодейства с кислород, халогени, сяра, азот, въглерод, водород и много метали.
Борът бавно реагира с такива силни окислители като флуор, гореща концентрирана азотна киселина и акварегия. Аморфният бор постепенно се разтваря при кипене в концентрирана алкал:
2B + 2NaOH + 2H20 \u003d 2NaBO 2 + 3H2
Latimer диаграма за бор:
1- -1,822
Борният триоксид В2О 3 е киселинен оксид. Известни са трите му хидратирани форми - борни киселини H 3 BO 3 - ортоборна киселина
HBO 2 - метаборна киселина
H 2 B 4 O 7 - тетраборна киселина
МИНИСТЕРСТВО НА ОБРАЗОВАНИЕТО И НАУКАТА НА РУСКАТА ФЕДЕРАЦИЯ
Държавна образователна институция за висше професионално образование
РУСКИ ДЪРЖАВЕН УНИВЕРСИТЕТ
МАСЛО И ГАЗ, кръстено на И.М. Губкин
РАЗПРЕДЕЛЕНИЕ НА МАСЛО И ГАЗ на РСУ, наречено на И.М. Губкин
в Оренбург
Изпит по дисциплината "Химия"
Проверих:
„__“ ____________ 2011 г.
Изработено от:
студент гр
„__“ ____________ 2011 г.
1 Взаимодействие на желязо и злато със солна, азотна, сярна и фосфорна киселина 3
2 Задачи 5
Референции 6
1 Взаимодействие на желязо и злато със солна, азотна, сярна и фосфорна киселина
Метали в реда на активност до водород (H2) го изместват от киселинен разтвор (с изключение на азотна киселина (HNO 3) с всякаква концентрация и концентрирана сярна киселина (H 2 SO 4)), ако образуваната сол е разтворима.
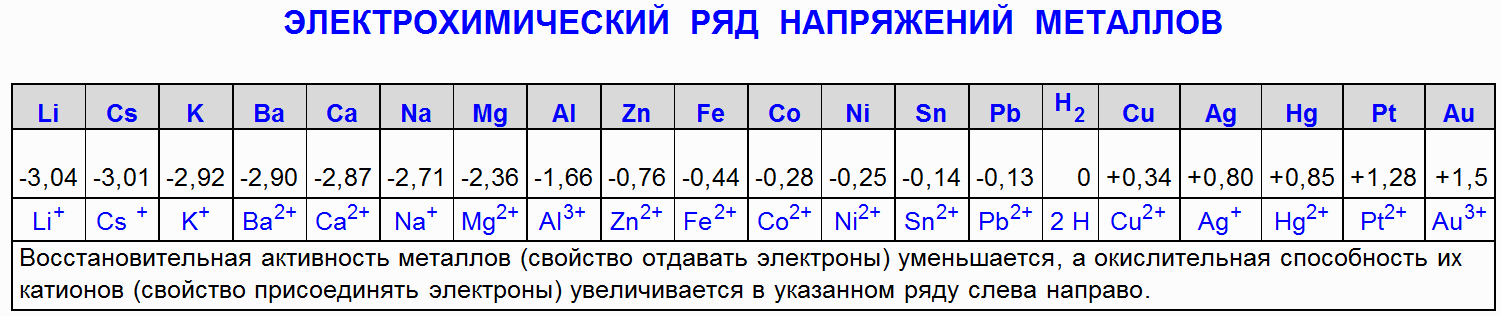
1.1 Взаимодействие на желязо (Fe) със солна киселина (HCl)
Желязото (Fe) реагира с концентрирана и разредена солна киселина (HCl), за да се получи железен хлорид (FeCl 2) и водород (H2):
Fe + 2HCl → FeCl 2 + H2
1.2 Взаимодействие на желязо (Fe) с азотна киселина (HNO 3)
Желязото (Fe) се пасивира с концентрирана азотна киселина, тоест се образува тънко повърхностно съединение, което предотвратява корозията.
Fe + 4HNO3 (25%) → Fe (NO 3) 3 + NO + 2H20
Желязото (Fe) взаимодейства с разредена азотна киселина и в зависимост от концентрацията на киселина се образуват не само различни продукти за редуциране на азот, но и различни продукти за окисляване на желязо:
4Fe + 10HNO 3 (2%) → Fe (NO 3) 2 + NH 4 NO 3 + 3H 2 O
1.3 Взаимодействие на желязо (Fe) със сярна киселина (H 2 SO 4)
Реакцията на желязо (Fe) с концентрирана сярна киселина протича с образуването на железен (III) сулфат:
2Fe + 6H 2 SO 4 (70%) → Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Желязото реагира с разредена сярна киселина и образува железни (II) соли:
Fe + H 2 SO 4 (20%) → FeSO 4 + H 2
1.4 Взаимодействие на желязо (Fe) с фосфорна киселина (H 3 PO 4)
Фосфорната киселина реагира с желязото много бавно, това е така, защото е триосновна киселина в броя на водородните атоми.
Фосфорната киселина се използва при почистване на желязо от ръжда (железни оксиди). Фосфорната киселина, отстранявайки оксида си от повърхността на метал, реагира много бавно със самото желязо. Железният оксид се превръща в разтворима сол на FePO 4, която се промива с вода заедно с остатъци от киселина.
2H 3 PO 4 + Fe 2 O 3 → 2FePO 4 + 3H 2 O
1.5 Взаимодействие на злато (Au) със солна (HCl), азотна (HNO 3), сярна (H 2 SO 4) и фосфорна (H 3 PO 4) киселина
Златото е най-инертният метал, стои в поредицата от напрежения вдясно от всички други метали, при нормални условия не взаимодейства с повечето киселини и не образува оксиди, поради което е класифициран като благороден метал, за разлика от обикновените метали, лесно разрушаващ се под въздействието на околната среда.
Au + H 2 SO 4 →
Au + H 3 PO 4 →
2 Задачи
2.1№ 4 (стр. 9)
16 g / mol
Отговор: Ъъъ мен \u003d 108 g / mol и Е S \u003d 16 g / mol
2.2№ 31 (стр. 32)
2.3 № 57 (стр. 57)
V газ \u003d 22,4 l / mol ∙ 0,045 mol \u003d 1 l
Отговорът е:V газове \u003d 1 л
Списък с референции
Глинка Н. Л. "Задачи и упражнения по обща химия." учебник за университети / изд. В. А. Рабинович и Х. М. Рубина - 22-ро издание, стереотип. 1984. - 264с., Ил.
Глинка Н. Л. „Учебник по обща химия“ за университети / изд. В. А. Рабинович - 20 изд., Стереотип. 1987.– 889 с., Ил.
Лебедева М. И., Анкудимова И. А. „Сборник от проблеми и упражнения по химия с решаването на типични и сложни проблеми: работилница“ Москва: Издателство „Машиностроение-1“, 2002. 166 с.
http://ru.wikipedia.org/
http://convertr.ru
Желязо - химичен елемент
1. Положението на желязото в периодичната таблица на химичните елементи и структурата на неговия атом
Желязото е d-елемент от група VIII; сериен номер - 26; атомна масаAr (Fe ) \u003d 56; атомен състав: 26 протона; 30 - неутрони; 26 - електрони.
Структурата на атома:
Електронна формула: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Метал със средно активно действие, редуциращ агент:
Fe 0 -2 e - → Fe +2 редуциращият агент се окислява
Fe 0 -3 e - → Fe +3 редуциращият агент се окислява
Основните състояния на окисляване: +2, +3
2. Преобладаването на желязото
Желязото е един от най-често срещаните елементи в природата. , В земната кора масовата му част е 5,1%, според този показател тя на второ място след кислород, силиций и алуминий, Много желязо се намира и в небесните тела, което се установява според спектралния анализ. Проби от желязо в неокислено състояние са открити в проби от лунна почва, доставени от автоматичната станция Луна.
Железните руди са доста широко разпространени на Земята. Имената на планините в Урал говорят сами за себе си: Висока, Магнетична, Желязна. Агрохимиците в почвата намират железни съединения.
Желязото е част от повечето скали. За получаване на желязо се използват железни руди със съдържание на желязо 30-70% или повече.
Основните железни руди са :
магнетит (магнитна желязна руда) - Fe 3 O 4 съдържа 72% желязо, находищата се намират в Южен Урал, Курска магнитна аномалия:
|
|
|
хематит (железен блясък, кръв) - Fe 2 O 3съдържа до 65% желязо, такива находища се намират в квартал Криворожски:
|
|
|
лимонит (кафява желязна руда) - Fe 2 O 3 * nH 2 O съдържа до 60% желязо; находища се намират в Крим:

пирит (серен пирит, железен пирит, котешко злато) - FeS 2 съдържа около 47% желязо; находищата се намират в Урал.

3. Ролята на желязото в живота и растенията на човека
Биохимиците са открили важната роля на желязото в живота на растенията, животните и хората. Като част от изключително сложно органично съединение, наречено хемоглобин, желязото определя червения цвят на това вещество, което от своя страна определя цвета на кръвта на хората и животните. Тялото на възрастен съдържа 3 g чисто желязо, 75% от което е част от хемоглобина. Основната роля на хемоглобина е прехвърлянето на кислород от белите дробове към тъканите и в обратна посока CO 2.
Желязото е необходимо и за растенията. Той е част от цитоплазмата, участва в процеса на фотосинтеза. Растенията, отглеждани върху субстрат без желязо, имат бели листа. Малка добавка на желязо към субстрата - и те стават зелени. Освен това си струва да намажете бял лист с разтвор на сол, съдържащ желязо, и скоро смазаното място става зелено.
Така че от една и съща причина - наличието на желязо в сокове и тъкани - листата на растенията весело позеленяват, а бузите на човек ярко зачервяват.
4. Физични свойства на желязото.
Желязото е сребристо-бял метал с температура на топене 1539 ° С. Той е много пластичен, така че лесно се обработва, кова, валцува, щампова. Желязото има способността да намагнетизира и демагнетизира, затова се използва като сърцевина на електромагнитите в различни електрически машини и устройства. Може да се получи по-голяма здравина и твърдост чрез термични и механични методи, например чрез закаляване и валцуване.
Има химически чисто и технически чисто желязо. Технически чистото желязо всъщност е нисковъглеродна стомана, съдържа 0,02-0,04% въглерод, а кислород, сяра, азот и фосфор са още по-малко. Химически чистото желязо съдържа по-малко от 0,01% примеси. Химически чисто желязо -сребристо сиво, лъскаво, на външен вид много подобно на платинен метал. Химически чистото желязо е устойчиво на корозия и е добре устойчиво на киселини. Въпреки това, нищожна част от примеси го лишава от тези ценни свойства.
5. Производство на желязо
Намаляване от оксиди на въглерод или въглероден оксид (II), както и на водород:
FeO + C \u003d Fe + CO
Fe 2O 3 + 3CO \u003d 2Fe + 3CO 2
Fe 2O 3 + 3H2 \u003d 2Fe + 3H20
Опит "Производство на желязо от алуминотермия"
6. Химични свойства на желязото
Като елемент на подгрупа желязото може да проявява няколко степени на окисление. Ще разгледаме само съединения, в които желязото има окислителни състояния от +2 и +3. Така можем да кажем, че желязото има два реда съединения, в които е двувалентно и тривалентно.
1) Във въздуха желязото лесно се окислява при наличие на влага (ръжда):
4Fe + 302 + 6H20 \u003d 4Fe (OH) 3
2) Червена гореща желязна тел гори в кислород, образувайки скала - железен оксид (II, III) - черно вещество:
3Fe + 2O 2 \u003d Fe 3 O 4
Cобразува се кислород във влажен въздух Fe 2 О 3 * пН 2 О
Опит "Взаимодействие на желязо с кислород"
3) При висока температура (700–900 ° C) желязото реагира с водна пара:
3Fe + 4H 2 O t˚C → Fe 3 O 4 + 4H 2
4) Желязото реагира с неметали при нагряване:
Fe + S t˚C → FeS
5) Желязото е лесно разтворимо в солна и разредена сярна киселина при обикновени условия:
Fe + 2HCl \u003d FeCl 2 + H2
Fe + H2S04 (разлагане) \u003d FeSO4 + H2
6) В концентрирани киселини - окислители, желязото се разтваря само при нагряване
2Fe + 6H 2 SO 4 (конц .) t˚C → Fe 2 (SO 4) 3 + 3SO 2 + 6H20
Fe + 6HNO 3 (конц .) t˚C → Fe (NO 3) 3 + 3NO 2 + 3H20Желязо (III)
7. Използването на желязо.
Основната част от желязото в света се използва за производството на чугун и стомана - сплави от желязо с въглерод и други метали. Чугунът съдържа около 4% въглерод. Стоманата съдържа по-малко от 1,4% въглерод.
Чугунът е необходим за производството на различни отливки - леглото на тежки машини и т.н.
Чугунени изделия
Стоманата се използва за производството на машини, различни строителни материали, греди, листове, валцувани изделия, релси, инструменти и много други продукти. За производството на различни видове стомана се използват така наречените легиращи добавки, които са различни метали: M
Машина за упражнения № 2 - Генетичен ред Fe 3+
Симулатор № 3 - Уравнения на реакциите на желязо с прости и сложни вещества
Присвояване на задания
№1. Направете уравненията за реакциите на получаване на желязо от неговите оксиди Fe 2 O 3 и Fe 3 O 4, като използвате като редуциращ агент:
а) водород;
б) алуминий;
в) въглероден оксид (II).
За всяка реакция направете електронен баланс.
№ 2. Проведете трансформациите по схемата:
Fe 2 O 3 -\u003e Fe - + H2O, t -\u003e X - + CO, t -\u003e Y - + HCl -\u003e Z
Какви са продуктите X, Y, Z?
Желязото проявява умерена химическа активност. Той изгаря в кислородна атмосфера, образувайки оксид Fe 2 O 3. В ситно разделено състояние металът е пирофорен, т.е. способни да се запалят спонтанно във въздуха. Фино желязо на прах може да се получи чрез термично разлагане на железен оксалат във водородна атмосфера.
Когато се съхранява на въздух при температури до 200 ° С, желязото постепенно се покрива от плътен оксиден филм, което предотвратява по-нататъшното окисляване на метала. При влажен въздух желязото е покрито с рохък слой ръжда, който не пречи на достъпа на кислород и влага до метала и неговото унищожаване. Ръждата няма постоянен химичен състав, приблизително нейната химическа формула може да бъде написана като Fe 2O3.
Желязото реагира с разтопена сяра до образуване на сулфид, активно взаимодейства с хлор, бром и йод с образуването на трихлорид, трибромид и дийодид. Желязото реагира слабо с флуор поради образуването на плътен, слабо летлив трифлуориден филм на повърхността. При температури над 500 ° C металът обратимо взаимодейства с въглерода:
Железният карбид от този състав се нарича циментит. Съдържа се в чугун и стомана.
Желязото реагира с кислорода при нагряване. Когато желязото се изгаря на въздух, се образува Fe 2O3 оксид, а когато се изгаря в чист кислород, се образува Fe 3O 4 оксид. Ако кислородът или въздухът преминават през разтопено желязо, тогава се образува FeO оксид.
При нагряване желязото реагира с азот, образувайки железен нитрид Fe3N, с фосфор, образувайки фосфиди FeP, Fe 2 P и Fe 3 P, с въглерод, образувайки карбид Fe 3 С, със силиций, образувайки няколко силицида, например FeSi. При повишено налягане металното желязо реагира с въглероден окис CO и се образува течност при нормални условия лесно летлив желязо пентакарбонил Fe (CO) 5. Железните карбонили от състави Fe 2 (CO) 9 и Fe 3 (CO) 12 също са известни. Железните карбонили служат като изходни материали при синтеза на органометални съединения, включително фероценов състав.
Чистото метално желязо е стабилно във вода и в разредени алкални разтвори. Желязото не се разтваря в концентрирани серни и азотни киселини, тъй като силен оксиден филм пасивира повърхността му. Желязото реагира със солна и разредена (приблизително 20%) сярна киселина, за да образува железни (II) соли:
Fe + 2HCl \u003d FeCl 2 + H2
Fe + H2S04 \u003d FeSO4 + H2
Когато желязото взаимодейства с приблизително 70% сярна киселина, реакцията протича с образуването на железен (III) сулфат:
2Fe + 4H 2 SO 4 \u003d Fe 2 (SO 4) 3 + SO 2 + 4H20
Под въздействието на атмосферна влага и въздух желязо разяжда (ръжда):
4Fe + 2H2O + 3O 2 \u003d 4FeO (OH)
Поради корозия, до 10% от цялото произведено желязо се губи годишно.
Много чистото желязо, съдържащо по-малко от 0,01% примеси на сяра, въглерод и фосфор, е устойчиво на корозия. В близост до град Делхи в Индия има железен стълб, поставен още през 9 век. Пр. Н. Е., Върху който няма следа от ръжда. Изработена е от много чист метал със съдържание на желязо 99,72%. Не на последно място ролята на корозионната устойчивост на материала на известните колони може да играе климатичните особености на тази зона.
При нагряване металното желязо взаимодейства с концентрирани (повече от 30%) разтвори на основи, образувайки хидроксокомплекси. Под въздействието на силни окислители, при нагряване желязото може да образува съединения в състояние на окисляване (+ VI) - ферати:
Fe + 2KNO 3 \u003d K 2 FeO 4 + 2NO
Оксидите и хидроксидите в окислителни състояния (II) и (III) са известни с желязо.
Желязото образува прости соли с почти всички аниони. Водните нитрати, сулфати, халогениди (с изключение на флуориди), ацетати и др. Катионът на желязо (II) може да се окисли от много окислители до катиона на желязо (III). Разтворите на соли на желязо (II) и неговите твърди соли постепенно се окисляват, дори когато се съхраняват на въздух:
4FeCO3 + 2H20 + O2 \u003d 4FeO (OH) + 2CO2
4FeS + 6H2O + O2 \u003d 4FeO (OH) + 4H2S
Най-стабилната твърда желязна (II) сол е желязо (II) -амониев сулфат хексахидрат (NH4) 2Fe (SO 4) 2.6H20 (сол на Мор).
При нагряване железните сулфати, нитрати, карбонати и оксалати се разлагат. В този случай желязото (II) обикновено се окислява до желязо (III), например:
2FeSO 4 \u003d Fe 2 O 3 + SO 3 + SO 2
Солите на желязото (III) са подложени на силна хидролиза.
Желязото е добре известен химичен елемент. Отнася се до метали със средна химическа активност. Свойствата и приложението на желязото ще разгледаме в тази статия.
Преобладаване в природата
Има доста голям брой минерали, които включват ферум. На първо място, това е магнетит. Това е седемдесет и два процента желязо. Химическата му формула е Fe 3 O 4. Този минерал се нарича още магнитна желязна руда. Има светлосив цвят, понякога с тъмносив, до черен, с метален блясък. Най-голямото му поле сред страните от ОНД е на Урал.
Следващият минерал с високо съдържание на желязо, хематит, е на седемдесет процента, съставен от този елемент. Химичната му формула е Fe 2 O 3. Нарича се още червена желязна руда. Има цвят от червено-кафяв до червено-сив. Най-голямото находище в страните от ОНД се намира в Кривой Рог.
Третият минерал на ферума е лимонит. Тук желязото е шестдесет процента от общата маса. Това е кристален хидрат, тоест молекулите на водата са вплетени в кристалната му решетка, химическата му формула е Fe 2 O 3 .H 2 O. Както подсказва името, този минерал има жълтеникавокафяв цвят, понякога кафяв. Той е един от основните компоненти на естествената охра и се използва като пигмент. Нарича се още кафява желязна руда. Най-големите места за среща са Крим и Урал.
В сидерит, т. Нар. Желязна руда, която е четиридесет и осем процента от ферума. Химичната му формула е FeCO 3. Структурата му е разнородна и се състои от кристали от различни цветове, свързани помежду си: сиво, бледозелено, сиво-жълто, кафяво-жълто и др.
Последният естествено срещащ се минерал с високо съдържание на ферум е пирит. Той притежава такива химична формула FeS 2. Желязото съдържа четиридесет и шест процента от общата маса. Благодарение на серните атоми, този минерал има златисто жълт цвят.
Много от изследваните минерали се използват за производството на чисто желязо. В допълнение, хематитът се използва при производството на бижута, изработени от естествени камъни. Пиритни включвания могат да бъдат намерени в бижутата с лапис лазури. Освен това желязото се намира в природата като част от живите организми - това е един от най-важните компоненти на клетката. Този микроелемент задължително трябва да влезе в човешкото тяло в достатъчни количества. Лечебните свойства на желязото се дължат до голяма степен на факта, че този химичен елемент е в основата на хемоглобина. Следователно употребата на ферум има добър ефект върху състоянието на кръвта и следователно върху целия организъм като цяло.
Желязо: физични и химични свойства
Нека помислим за подреждането на тези два големи раздела. Желязото е неговият вид, плътност, точка на топене и пр. Тоест, всички отличителни характеристики на материята, които са свързани с физиката. Химичните свойства на желязото са способността му да реагира с други съединения. Нека започнем с първото.
Физични свойства на желязото
В чистата си форма при нормални условия е твърдо вещество. Има сребристосив цвят и подчертан метален блясък. Механичните свойства на желязото включват ниво на твърдост на Mohs. Тя е равна на четири (средно). Желязото има добра електрическа и топлопроводимост. Последната характеристика може да се усети, като докоснете железен предмет в студено помещение. Тъй като този материал бързо отвежда топлината, той отнема голяма част от кожата ви за кратък период от време и следователно се чувствате студени.  Докосвайки например дърво, може да се отбележи, че неговата топлопроводимост е много по-ниска. Физическите свойства на желязото са неговите точки на топене и кипене. Първият е 1539 градуса по Целзий, вторият - 2860 градуса по Целзий. Може да се заключи, че характерните свойства на желязото са добра пластичност и стопяемост. Но това далеч не е всичко.
Докосвайки например дърво, може да се отбележи, че неговата топлопроводимост е много по-ниска. Физическите свойства на желязото са неговите точки на топене и кипене. Първият е 1539 градуса по Целзий, вторият - 2860 градуса по Целзий. Може да се заключи, че характерните свойства на желязото са добра пластичност и стопяемост. Но това далеч не е всичко.
Също в физически свойства желязото влиза и неговият феромагнетизъм. Какво е това? Желязото, чиито магнитни свойства можем да наблюдаваме на практически примери всеки ден, е единственият метал с такава уникална отличителна черта. Това е така, защото този материал е в състояние да се намагнетизира под въздействието на магнитно поле. А след прекратяването на последното желязото, чиито магнитни свойства току-що са се образували, остава магнит за дълго време. Това явление може да се обясни с факта, че в структурата на този метал има много свободни електрони, които са в състояние да се движат.
По отношение на химията
Този елемент се отнася до метали със средна активност. Но химичните свойства на желязото са характерни за всички други метали (с изключение на тези, които са вдясно от водорода в електрохимичната серия). Той е в състояние да реагира с много класове вещества.
Нека започнем с прости
Ферум взаимодейства с въглерод, азот, халогени (йод, бром, хлор, флуор), фосфор, въглерод. Първото нещо, което трябва да се вземе предвид, е реакцията с кислород. Когато ферумът изгори, се образуват неговите оксиди. В зависимост от условията на реакцията и пропорциите между двамата участници, те могат да бъдат различни. Като пример за такива взаимодействия могат да бъдат дадени следните реакционни уравнения: 2Fe + O 2 \u003d 2FeO; 4Fe + 302 \u003d 2Fe 2O 3; 3Fe + 2O 2 \u003d Fe 3 O 4. И свойствата на железния оксид (както физични, така и химични) могат да бъдат най-различни, в зависимост от неговото разнообразие. Този вид реакция се проявява при високи температури.

Следва взаимодействие с азот. Може да се появи и само при нагряване. Ако вземем шест мола желязо и един мол азот, получаваме два бенки железен нитрид. Реакционното уравнение ще изглежда по следния начин: 6Fe + N2 \u003d 2Fe 3 N.
При взаимодействие с фосфор се образува фосфид. Следните компоненти са необходими за провеждане на реакцията: за три бен ферума, един мол фосфор, в резултат се образува един мол фосфид. Уравнението може да се запише по следния начин: 3Fe + P \u003d Fe 3 P.
Освен това сред реакциите с прости вещества може да се разграничи и взаимодействието със сяра. В този случай може да се получи сулфид. Принципът, по който протича процесът на образуване на това вещество, е подобен на описания по-горе. А именно, възниква реакцията на добавяне. За всички химически взаимодействия от този вид са необходими специални условия, главно високи температури, по-рядко катализатори.
Реакциите между желязо и халогени също са често срещани в химическата промишленост. Това са хлориране, бромиране, йодиране, флуориране. Както става ясно от наименованията на самите реакции, това е процесът на свързване на атоми хлор / бром / йод / флуор към ферумни атоми с образуването съответно на хлорид / бромид / йодид / флуорид. Тези вещества се използват широко в различни индустрии. В допълнение, ферумът е в състояние да се комбинира със силиций при високи температури. Поради факта, че химични свойства желязото е разнообразно, често се използва в химическата промишленост.
Ферум и сложни вещества
от прости вещества нека да преминем към тези, чиито молекули се състоят от два или повече различни химични елемента. Първото нещо, което трябва да се спомене, е реакцията на ферум с вода. Тук се проявяват основните свойства на желязото. Когато водата се нагрява, тя се образува заедно с желязо (нарича се така, защото при взаимодействие със същата вода образува хидроксид, с други думи основата). Така че, ако вземете един мол от двата компонента, се образуват вещества като ферумов диоксид и водород под формата на газ с остра миризма - също в моларни пропорции от един към един. Уравнение на този вид реакция може да бъде написано, както следва: Fe + H20 \u003d FeO + H2. В зависимост от пропорциите, в които да се смесват тези два компонента, е възможно да се получи желязо или триоксид. И двете вещества са много разпространени в химическата промишленост и се използват и в много други индустрии.
С киселини и соли
Тъй като ферумът е разположен вляво от водорода в електрохимичната серия на металната активност, той е в състояние да измести този елемент от съединенията. Пример за това е реакцията на заместване, която може да се наблюдава при добавяне на желязо към киселината. Например, ако смесим желязо и сулфатна киселина (тя е сярна) със средна концентрация в същите молни пропорции, в резултат ще получим железен сулфат (II) и водород в същите молни пропорции. Уравнението на такава реакция ще изглежда така: Fe + H 2 SO 4 \u003d FeSO 4 + H2.
При взаимодействие със соли се проявяват редуциращите свойства на желязото. Тоест, с него можете да изберете по-малко активен метал от солта. Например, ако вземете един мол и същото количество ферум, можете да получите железен сулфат (II) и чист мед в същите молни пропорции.
Стойност за тялото
Един от най-разпространените химични елементи в земната кора е желязото. вече сме обмислили, сега ще подходим към нея от биологична гледна точка. Ферум изпълнява много важни функции както на клетъчно ниво, така и на ниво на целия организъм. На първо място желязото е в основата на такъв протеин като хемоглобин. Той е необходим за транспортирането на кислород през кръвта от белите дробове до всички тъкани, органи, до всяка клетка на тялото, предимно до невроните на мозъка. следователно полезни свойства желязото не може да бъде надценено

Освен че влияе върху образуването на кръв, ферумът е важен и за пълноценното функциониране на щитовидната жлеза (това изисква не само йод, както някои хора смятат). Също така желязото участва в междуклетъчния метаболизъм, регулира имунитета. Дори ферумът се намира в особено големи количества в чернодробните клетки, тъй като помага за неутрализиране на вредните вещества. Той е и един от основните компоненти на много видове ензими в нашето тяло. В ежедневната диета на човек трябва да съдържа от десет до двадесет милиграма от този микроелемент.
Храни, богати на желязо
Има много от тях. Те са както от растителен, така и от животински произход. Първите са зърнени храни, бобови растения, зърнени култури (особено елда), ябълки, гъби (бели), сушени плодове, шипчици, круши, праскови, авокадо, тиква, бадеми, фурми, домати, броколи, зеле, боровинки, къпини, целина и др. Второто е черният дроб, месото. Употребата на храни с високо съдържание на желязо е особено важна по време на бременност, тъй като тялото на формиращия се плод изисква голямо количество от този микроелемент за пълен растеж и развитие.
Признаци за липса на желязо в организма
Симптомите на твърде малко феруми, които влизат в тялото, включват умора, постоянно замръзване на ръцете и краката, депресия, чуплива коса и нокти, намалена интелектуална активност, храносмилателни разстройства, лошо представяне и проблеми с щитовидната жлеза. Ако забележите няколко от тези симптоми, трябва да увеличите броя на храните с желязо в диетата си или да си купите витамини или хранителни добавки, съдържащи ферум. Вие също трябва да се консултирате с лекар, ако почувствате някой от тези симптоми твърде остро. 
Използването на ферум в промишлеността
Употребата и свойствата на желязото са тясно свързани. Поради феромагнетизма си, той се използва за производството на магнити - както по-слаби за домакински цели (сувенирни магнити за хладилник и др.), Така и по-здрави за промишлени цели. Поради факта, че въпросният метал има висока якост и твърдост, той се използва от древни времена за производството на оръжия, броня и други военни и домакински инструменти. Между другото, още в Древен Египет е било известно метеоритно желязо, чиито свойства са по-добри от тези на обикновения метал. Също така такова специално желязо се е използвало в древен Рим. От него са направени елитни оръжия. Щит или меч, направен от метеоритен метал, можеше да има само един много богат и благороден човек.

Като цяло металът, който разглеждаме в тази статия, е най-универсалният, използван сред всички вещества от тази група. На първо място от него се изработват стомана и чугун, които се използват за производството на всякакви продукти, необходими както в промишлеността, така и в ежедневието.
Чугунът е сплав от желязо и въглерод, в който вторият присъства от 1,7 до 4,5 процента. Ако вторият е под 1,7 процента, тогава този вид сплав се нарича стомана. Ако в състава има около 0,02 процента въглерод, тогава това е обикновено техническо желязо. Наличието на въглерод в сплавта е необходимо, за да му придаде по-голяма здравина, топлинна устойчивост и устойчивост на ръжда.
В допълнение, стоманата може да съдържа много други химически елементи като примеси. Това е манган, фосфор и силиций. Също така, хром, никел, молибден, волфрам и много други химически елементи могат да бъдат добавени към този вид сплав, за да му придадат определени качества. Видовете стомана, в които присъства голямо количество силиций (около четири процента), се използват като трансформатор. Тези, които съдържат много манган (до дванадесет до четиринадесет процента), намират приложението си в производството на части от железници, мелници, трошачки и други инструменти, части от които са подложени на бърза абразия.
Молибденът се въвежда в сплавта, за да стане по-устойчив на топлина - такива стомани се използват като инструментални стомани. Освен това, за да се получи неръждаема стомана, известна и често използвана в ежедневието под формата на ножове и други домакински инструменти, е необходимо да се добавят хром, никел и титан в сплавта. И за да получите удароустойчива, високоякостна, пластична стомана, просто добавете ванадий към нея. При въвеждане на ниобий в състава може да се постигне висока устойчивост на корозия и химически агресивни вещества.
Минералният магнетит, споменат в началото на статията, е необходим за производството на твърди дискове, карти с памет и други устройства от този тип. Поради своите магнитни свойства желязото може да бъде намерено в трансформатори, двигатели, електронни продукти и др. Освен това ферумът може да се добавя към сплави от други метали, за да им осигури по-голяма здравина и механична стабилност. Сулфатът на този елемент се използва в градинарството за борба с вредители (заедно с меден сулфат).  са незаменими при пречистване на вода. В допълнение, магнетит на прах се използва в черно-бели принтери. Основният метод за използване на пирит е получаването на сярна киселина от него. Този процес протича в лабораторни условия на три етапа. На първия етап пиритът на ферума се изгаря, като по този начин се получава железен оксид и серен диоксид. На втория етап превръщането на серен диоксид в негов триоксид става с участието на кислород. И на последния етап полученото вещество се пропуска през присъствието на катализатори, като по този начин се получава сярна киселина.
са незаменими при пречистване на вода. В допълнение, магнетит на прах се използва в черно-бели принтери. Основният метод за използване на пирит е получаването на сярна киселина от него. Този процес протича в лабораторни условия на три етапа. На първия етап пиритът на ферума се изгаря, като по този начин се получава железен оксид и серен диоксид. На втория етап превръщането на серен диоксид в негов триоксид става с участието на кислород. И на последния етап полученото вещество се пропуска през присъствието на катализатори, като по този начин се получава сярна киселина.
Производство на желязо
Този метал се добива главно от двата му основни минерала: магнетит и хематит. Те правят това чрез намаляване на желязото от неговите съединения с въглерод под формата на кокс. Това се прави в доменни пещи, температурата на които достига две хиляди градуса по Целзий. Освен това има начин за възстановяване на ферума с водород. За това не е необходима доменна пещ. За да приложат този метод, те вземат специална глина, смесват я с натрошена руда и я обработват с водород в шахтна пещ.
заключение
Свойствата и употребата на желязото са разнообразни. Това е може би най-важният метал в нашия живот. След като стана известен на човечеството, той зае мястото на бронз, който по онова време беше основният материал за производството на всички инструменти, както и оръжия. Стоманата и чугунът в много отношения превъзхождат сплавите на мед с калай по отношение на техните физически свойства и устойчивост на механични натоварвания.
Освен това желязото на нашата планета е по-разпространено от много други метали. тя в земната кора е почти пет процента. Това е четвъртият най-изобилен химичен елемент в природата. Също така, този химичен елемент е много важен за нормалното функциониране на организма на животни и растения, преди всичко защото на негова основа се изгражда хемоглобин. Желязото е основен микроелемент, използването на който е важно за поддържане на здравето и нормалното функциониране на органите. В допълнение към горното, това е единственият метал, който има уникални магнитни свойства. Без ферум е невъзможно да си представим живота си.




