Dispositifs méthodes pour la production d'acide sulfurique. Contacter la production d'acide sulfurique
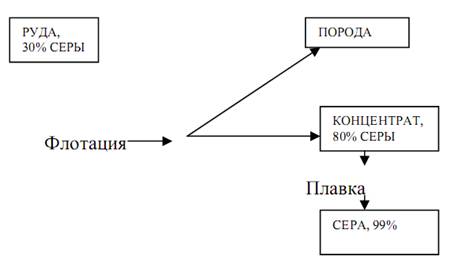
La production d'acide sulfurique par la méthode du contact comprend quatre étapes: la production de dioxyde de soufre; purification de gaz à partir d'impuretés, obtention de trioxyde de soufre; absorption de trioxyde de soufre.
La première étape implique la production de dioxyde à partir de pyrites, qui sont brûlées dans des fours où se produit une réaction irréversible. Le gaz de combustion après le nettoyage de la poussière dans les précipitateurs électrostatiques a une température d'environ 350 ° C et contient des résidus de poussière, ainsi que des impuretés gazeuses de composés d'arsenic (As2O3), de sélénium (SeO2) et d'autres éléments qui peuvent détruire le catalyseur et réduire son activité. Il est conseillé d'extraire les impuretés de sélénium du gaz et comme matériau nécessaire à l'industrie. Un système de tours de lavage, de précipitateurs électrostatiques et de tours de séchage est prévu pour la purification des gaz. La troisième étape de la production d'acide sulfurique est la principale. Le gaz purifié sec entre dans l'oxydation par contact du SO2 en SO3, qui se produit par une réaction exothermique réversible, qui se produit avec une diminution du volume de gaz:
Le taux d'oxydation du SO2 en l'absence de catalyseur est même faible à haute température.
Les usines d'acide sulfurique de notre pays utilisent principalement des masses de contact de vanadium avec une teneur en V2O d'environ 7%, ainsi que des oxydes de métaux alcalins et des aluminosilicates hautement poreux comme supports.
Dans la quatrième étape du processus de production d'acide sulfurique, le gaz oxydé refroidi est envoyé au service d'absorption (absorption) de l'atelier. Il n'est pas pratique d'absorber le trioxyde avec de l'eau, car la réaction SOs + FbO ^ HaSO ^ Q se déroulera en phase gazeuse (en raison de la chaleur dégagée, l'eau se transforme en vapeur) avec formation de minuscules gouttelettes d'acide (brouillard), ce qui est très difficile à capter. Par conséquent, le SO3 est absorbé dans l'acide sulfurique concentré en deux étapes.
50. Domaines d'application de l'acide sulfurique et indicateurs techniques et économiques de sa production.
La production d'acide sulfurique - l'un des acides les plus forts et les moins chers - est d'une grande importance économique, en raison de son utilisation répandue dans diverses industries.
L'acide sulfurique anhydre (monohydraté) est un liquide huileux lourd (densité à 20 ° C 1830 kg / m3, point d'ébullition 296,2 ° C à pression atmosphérique; température de cristallisation 10,45 ° C). Il se mélange à l'eau dans n'importe quel rapport avec un dégagement de chaleur important (des hydrates se forment). L'oxyde de soufre se dissout dans l'acide sulfurique. Une telle solution, dont la composition est caractérisée par la teneur en SO3 libre, est appelée oléum.
L'acide sulfurique est utilisé pour la production d'engrais - superphosphate, ammophos, sulfate d'ammonium, etc. Sa consommation est importante dans le raffinage des produits pétroliers, ainsi que dans la métallurgie non ferreuse et dans la gravure sur métal. L'acide sulfurique très pur est utilisé dans la fabrication de colorants, vernis, peintures, substances médicinales, certains plastiques, fibres chimiques, de nombreux pesticides, explosifs, éthers, alcools, etc.
L'acide sulfurique est produit de deux manières: contact et nitreux (tour). Environ 90% de la production totale d'acide est obtenue par la méthode du contact, car cela garantit une concentration et une pureté élevées du produit.
Comme matières premières pour la production d'acide sulfurique sont utilisées soufre élémentaire et pyrite de soufre; De plus, les déchets industriels contenant du soufre sont largement utilisés.
La pyrite de soufre se caractérise par une teneur en soufre de 35 ... 50%. Les minerais sulfurés, qui sont utilisés dans la production de métaux non ferreux (Cu, Zn, Pb, etc.), sont souvent présents dans les dépôts de pyrite de soufre.
Les minerais sulfurés sont calcinés, au cours desquels se forment des gaz de dioxyde de soufre, qui sont utilisés pour produire de l'acide sulfurique. Actuellement, les gaz de sulfure d'hydrogène générés lors du traitement du pétrole, du charbon à coke, ainsi que ceux issus de la purification du gaz naturel servent de matières premières pour sa production.
La plus simple est la production d'acide sulfurique à partir de soufre, extrait de minerais natifs ou de sous-produits d'un certain nombre d'industries (soufre gazeux). Cependant, le coût de l'acide obtenu à partir du soufre est plus élevé que celui des pyrites. De plus, le soufre est nécessaire à la production de caoutchouc, d'allumettes, de disulfure de carbone, de pesticides, de médicaments, etc.
Au stade actuel, l'approvisionnement de l'industrie en matières premières contenant du soufre est assuré par le développement du soufre naturel et la production du soufre associé. Dans les industries de la métallurgie non ferreuse et ferreuse, du gaz et de la pétrochimie, le soufre est obtenu à partir des condensats de gaz. Par conséquent, la production de pyrites de flottation dans les entreprises de métallurgie non ferreuse augmente.
Une technologie est en cours de développement pour le traitement de nouveaux types de matières premières: la torréfaction sulfatée du concentré de sulfure collectif du complexe Sokolovsko-Sarbaisky et la torréfaction des pyrites de qualité inférieure.
Le processus de production d'acide sulfurique par la méthode du contact est grandement simplifié si le soufre, qui est presque exempt d'arsenic, ou le sulfure d'hydrogène provenant de la purification des gaz combustibles et des produits pétroliers sont utilisés comme matières premières pour la production de SO. Lors de l'utilisation du soufre fondu comme matière première, le processus de production d'acide sulfurique comprend trois étapes: la combustion du soufre dans les fours à buses; oxydation du dioxyde de soufre en trioxyde dans les dispositifs de contact; absorption de trioxyde de soufre.
L'industrie produit de l'acide sulfurique technique, batterie et réactif. Ces types d'acides diffèrent par le but et la teneur du composant principal et des impuretés.
La perspective en termes d'amélioration des indicateurs techniques et économiques de la production d'acide sulfurique sont les systèmes d'épuration des gaz secs. La méthode de contact classique pour sa production comprend un certain nombre de processus opposés: le gaz de calcination chaud est refroidi dans le service de traitement, puis chauffé à nouveau au contact; dans les tours de lavage, le gaz est humidifié, dans les tours de séchage, il est complètement drainé. En URSS, sur la base de recherches scientifiques, un nouveau procédé de production d'acide sulfurique a été créé - le nettoyage à sec (CO). La principale caractéristique du procédé CO est qu'après le dépoussiérage, le gaz de calcination chaud sans refroidissement, lavage et séchage est envoyé directement à l'appareil de contact. Ceci est assuré par un tel mode de fonctionnement des fours avec une couche de pyrite en suspension (bouillante), dans laquelle une partie importante des composés de l'arsenic est adsorbée par le cendre. Ainsi, au lieu des quatre étapes du processus classique, le CO n'en comprend que trois, grâce auxquelles les investissements en capital sont réduits de 15 ... 25%, le coût de l'acide sulfurique - de 10 ... 15%.
Il est prévu d'augmenter les capacités des entreprises existantes et en construction pour la production d'acide sulfurique par méthode de contact à un faible coût supplémentaire. Cet objectif sera atteint en augmentant la concentration de SO2 dans les gaz traités, ainsi qu'en introduisant un schéma court lors du passage de la pyrite à la combustion du soufre. Afin d'améliorer la conception matérielle du procédé, un appareil de contact avec des couches de catalyseur parallèles a été développé (sa consommation de métal a diminué de 25%). L'utilisation de réfrigérateurs à coque et à tube avec protection d'anode étendra leur durée de vie à 10 ans.
La technologie de production d'acide sulfurique par la méthode nitreuse est mise à jour en améliorant les systèmes de tours. Les calculs montrent que, par rapport à la méthode de contact pour le traitement des gaz obtenus en tirant des pyrites dans l'air, avec la méthode nitreuse et en installant la même capacité (180 mille tonnes par an), les coûts d'investissement sont réduits de 43,6%, le coût du traitement du dioxyde de soufre - de 45 , 5, a réduit les coûts - de 44,7% et l'intensité du travail - de 20,2%.
Les gros consommateurs d'acide sulfurique devraient le produire dans leur entreprise, quelle que soit leur affiliation départementale, cela réduira la charge sur le transport ferroviaire et le besoin de citernes de 3 fois.
L'utilisation d'acides sulfuriques usés dans la production d'engrais minéraux augmentera après leur purification et leur régénération.
MINISTÈRE DE L'ÉDUCATION DE LA RÉPUBLIQUE DU BÉLARUS
UNIVERSITÉ ÉCONOMIQUE DE L'ÉTAT BÉLARUSIEN
Département de technologie
Travail individuel sur le sujet:
"Production d'acide sulfurique par méthode de contact."
Réalisé par un étudiant de 1ère année de FWA: Klimenok M. A.
Vérifié par l'enseignant: Tarasevich V. A.
Minsk 2002
· Résumé
· Description de la méthode de contact pour la production d'acide sulfurique
· Le schéma technologique de base de la production d'acide sulfurique par méthode de contact
· Dynamique des coûts salariaux dans le développement du processus technologique
· Calcul du niveau de technologie, de ces armes et de la productivité du travail vivant
· Conclusion
· Littérature et sources
Ce travail comprend 12 pages.
Mots-clés: acide sulfurique, Méthode de contact, Réaction, Technologie de production, Dynamique des coûts de main-d'œuvre, Processus technologique.
Dans ce travail, la technologie de production de soufre par contact a été étudiée et décrite. Des illustrations, des graphiques, des graphiques et des tableaux reflétant l'essence du processus sont fournis. Les tendances les plus importantes dans le développement de la production d'acide sulfurique par la méthode de contact sont identifiées
L'analyse de la dynamique du coût du travail de la vie et du travail passé, ainsi que la dynamique du coût du travail dans le développement du processus technologique. Le niveau de technologie, d'armement et de productivité du travail vivant est calculé. Des conclusions et des conclusions sont tirées.
Description de la méthode de contact pour la production d'acide sulfurique
La méthode de contact produit un grand nombre de variétés d'acide sulfurique, y compris de l'oléum contenant 20% de SO3 libre, de l'huile de vitriol (92,5% H 2 SO 4 et 7,5% H 2 O), de l'acide de batterie, à peu près à la même concentration que et de l'huile de vitriol, mais plus propre.
La méthode de contact pour la production d'acide sulfurique comprend trois étapes: purification du gaz des impuretés nocives pour le catalyseur; oxydation par contact du dioxyde de soufre en soufre; absorption d'anhydride sulfurique par l'acide sulfurique. L'étape principale est l'oxydation par contact du SO 2 en SO 3; le nom de cette opération fait référence à l'ensemble de la méthode.
L'oxydation par contact du dioxyde de soufre est un exemple typique de catalyse exothermique oxydative hétérogène. C'est l'une des synthèses catalytiques les plus étudiées.
Équilibre de réaction réversible
2SO 2 + O 2\u003e< 2 SO 3 + 2 x 96,7 кдж (500 оС) (а)
conformément au principe Le Chatelier, il se déplace vers la formation de SO 3 avec une température décroissante et une pression croissante; en conséquence, le degré d'équilibre de conversion du SO 2 en SO 3 augmente
Il est à noter qu'une augmentation de pression augmente naturellement la vitesse de réaction (a). Cependant, il est irrationnel d'utiliser une pression accrue dans ce processus, car en plus de faire réagir les gaz, l'azote de ballast devrait être comprimé, ce qui représente généralement 80% de l'ensemble du mélange et, par conséquent, les catalyseurs sont activement utilisés dans le cycle de production.
Le catalyseur le plus actif est le platine, cependant, il n'est plus utilisé en raison du coût élevé et de l'empoisonnement facile par les impuretés du gaz brûlé, en particulier l'arsenic. L'oxyde de fer est bon marché, mais avec la composition gazeuse habituelle de 7% SO2 et 11% O2, il ne présente une activité catalytique qu'à des températures supérieures à 625 ° C, c'est-à-dire lorsque XP 70%, et a donc été utilisé uniquement pour l'oxydation initiale du SO2 pour atteindre XP 50-60%. Le catalyseur au vanadium est moins actif que le platine, mais moins cher et empoisonné par les composés de l'arsenic plusieurs milliers de fois moins que le platine; il s'est avéré être le plus rationnel et seul il est utilisé dans la production d'acide sulfurique. La masse de contact avec le vanadium contient en moyenne 7% de V2O5; les activateurs sont des oxydes de métaux alcalins; l'activateur K2O est généralement utilisé; le support est des aluminosilicates poreux. Actuellement, le catalyseur est utilisé sous forme de composés SiO2, K  et / ou Cs, V dans différentes proportions. Un tel composé s'est avéré être le plus résistant à l'acide et le plus stable. Partout dans le monde, son nom plus correct est "contenant du vanadium". Un tel catalyseur est spécialement conçu pour fonctionner à basse température, ce qui entraîne une baisse des émissions. De plus, une telle catalyse est moins chère que le potassium / vanadium. Les masses de contact courantes avec le vanadium sont des granules, des comprimés ou des anneaux poreux (Fig. 1).
et / ou Cs, V dans différentes proportions. Un tel composé s'est avéré être le plus résistant à l'acide et le plus stable. Partout dans le monde, son nom plus correct est "contenant du vanadium". Un tel catalyseur est spécialement conçu pour fonctionner à basse température, ce qui entraîne une baisse des émissions. De plus, une telle catalyse est moins chère que le potassium / vanadium. Les masses de contact courantes avec le vanadium sont des granules, des comprimés ou des anneaux poreux (Fig. 1).
Dans des conditions de catalyse, l'oxyde de potassium est converti en K2S2O7, et la masse de contact est généralement un support poreux, dont la surface et les pores sont humidifiés avec un film d'une solution de pentoxyde de vanadium dans du pyrosulfate de potassium liquide.
La masse de contact avec le vanadium fonctionne à des températures de 400 à 600 ° C. Avec une augmentation de la température supérieure à 600 ° C, une diminution irréversible de l'activité du catalyseur commence en raison du frittage des composants avec la formation de composés inactifs insolubles dans le pyrosulfate de potassium. Avec une température décroissante, l'activité du catalyseur diminue fortement en raison de la conversion du vanadium pentavalent en tétravalent avec la formation de vanadyl VOSO4 inactif.
Le processus de catalyse comprend les étapes: 1) diffusion des composants réactifs des noyaux du flux gazeux vers les granules, puis dans les pores de la masse de contact; 2) sorption d'oxygène par le catalyseur (transfert d'électrons du catalyseur aux atomes d'oxygène); 3) sorption des molécules de SO2 avec formation du complexe catalyseur SO2 * O *; 4) réarrangement des électrons avec la formation du complexe catalyseur SO2 *; 5) désorption du SO3 des pores de la masse de contact et de la surface des grains.
Avec de gros granules de masse de contact, la vitesse totale du processus est déterminée par la diffusion des réactifs (1er et 6e étages). Ont généralement tendance à obtenir des granulés ne dépassant pas 5 mm de diamètre; le processus se déroule aux premiers stades d'oxydation dans la diffusion, et au dernier (à x 80%) dans la région cinétique.
En raison de la destruction et de l'agglutination des granules, de la contamination de la couche, de l'empoisonnement du catalyseur par les composés de l'arsenic et de ses dommages de température en cas de violations accidentelles du régime, la masse de contact avec le vanadium est remplacée en moyenne après 4 ans. Si la purification des gaz obtenue par cuisson des pyrites est interrompue, le fonctionnement de l'appareil de contact est interrompu en raison d'un empoisonnement de la première couche de la masse de contact après quelques jours. Pour préserver l'activité du catalyseur, une purification de gaz mince par la méthode humide est utilisée.
Schéma de principe de la production d'acide sulfurique par méthode de contact
Les meilleures matières premières pour la production gaz acide sert de soufre, qui est fondu à partir de roches naturelles contenant du soufre, et également obtenu comme sous-produit dans la production de cuivre, dans la purification des gaz, etc. Le soufre fond à une température de 113 degrés C, il est hautement inflammable et brûle dans des fours simples (Fig.2). Il se révèle un gaz de forte concentration, avec une faible teneur en impuretés nocives.
Le soufre est brûlé par la réaction S + O 2\u003e SO 2 + 296 kJ. En fait, le soufre fond et s'évapore avant de brûler (c.-à-d. Bp ~ 444 ° C) et brûle en phase gazeuse. Ainsi, le processus de combustion lui-même est homogène.

Compresseur et chambre de combustion
Soufre non brûlé
Combustion de soufre et air de combustion
Soufre liquide
Air comprimé
Produit - Gaz de combustion

organigramme de production d'acide sulfurique
1 - 1ère tour de lavage; 2 - 2ème tour de lavage avec buse; 3 - précipitateur électrostatique humide; 4 - tour de séchage avec buse; 5 - un turbocompresseur; 6 - échangeur de chaleur tubulaire; 7 - dispositif de contact; 8 - réfrigérateur à gaz tubulaire; 9 et 10 - tours d'absorption avec buse; 11 - pompes centrifuges; 12 - collections acides; 13 - réfrigérateurs à acide
Après un nettoyage grossier de la poussière des précipitateurs électrostatiques de cendre à une température d'environ 300 ° C, le gaz de calcination pénètre dans la tour de lavage creuse (Fig.3: 1,2), où de l'acide sulfurique froid (75% H 2 SO 4) est pulvérisé. Lorsque le gaz est refroidi, l'anhydride sulfurique qu'il contient et la vapeur d'eau se condensent sous forme de minuscules gouttelettes. L'oxyde d'arsenic est dissous dans ces gouttelettes. Il se forme un brouillard d'acide arsénique qui est partiellement capté dans la première tour et dans la seconde tour avec une buse en céramique. En même temps, des traces de poussière, de sélénium et d'autres impuretés sont capturées. De l'acide sulfurique sale se forme (jusqu'à 8% de la production totale), qui est donné comme produits non standard. La purification finale du gaz à partir du brouillard insaisissable d'acide arsenic est effectuée dans des filtres humides (Fig. 3: 3), qui sont installés en série (deux ou trois). Le principe de fonctionnement des filtres humides est le même que celui des filtres secs. Des gouttelettes de brouillard se déposent sur des électrodes de précipitation tubulaires en plomb ou en plastique «ATM» et s'écoulent vers le bas. La purification du gaz est terminée en la séchant de la vapeur d'eau avec de l'huile de sulfate dans une tour avec une buse (Fig. 3: 4). Habituellement, deux tours de séchage sont installées. Les tours, les conduits et les collecteurs d'acide du service de nettoyage installent généralement de l'acier, doublé de briques résistantes aux acides ou de carreaux de diabase. Le dioxyde de soufre sec et l'anhydride sulfurique ne sont pas agressifs, par conséquent, tous les équipements ultérieurs jusqu'à l'absorbeur monohydraté peuvent être montés en acier au carbone ordinaire sans protection contre la corrosion.
Un grand nombre d'équipements crée une résistance importante au flux de gaz (jusqu'à 2 m de colonne d'eau), donc un turbocompresseur est installé pour le transport de gaz (Fig. 3: 5). Le compresseur, aspirant le gaz des fours à travers l'ensemble de l'équipement, le pompe dans le nœud de contact.
Le nœud de contact (Fig. 3: 6, 7, 8) se compose d'un appareil de contact, d'un échangeur de chaleur à coque et à tube, et non représenté sur le diagramme (Fig. 4). chauffe-eau à gaz. Dans l'échangeur de chaleur du chauffage de démarrage, le gaz se réchauffe avant d'entrer dans l'appareil lors du démarrage ou lorsque la température dans l'appareil tombe en dessous de la normale.
Dispositifs de contact d'étagère habituellement utilisés. Un tel dispositif a un corps cylindrique d'un diamètre de 3 à 10 et une hauteur de 10 à 20 m. Quatre à cinq réseaux avec une couche de granules de masse de contact sur chacun d'eux sont installés à l'intérieur du corps. Des échangeurs de chaleur tubulaires intermédiaires ou en forme de boîte sont installés entre les couches de masse de contact. Le diagramme montre un appareil de contact à quatre couches, bien que les appareils à cinq couches soient plus souvent utilisés, mais le principe de leur fonctionnement est complètement similaire, la différence n'est que dans une couche de plus du catalyseur. Le gaz frais est chauffé par la chaleur du gaz chaud ayant réagi d'abord dans un échangeur de chaleur externe, puis il passe partiellement ou complètement pour chauffer trois ou quatre échangeurs de chaleur internes en série, à 440-450 ° C il entre dans la première couche de masse de contact. Cette température est contrôlée en ouvrant les vannes d'arrêt. Le but principal des échangeurs de chaleur internes est de refroidir le gaz partiellement oxydé et chauffé dans le lit de catalyseur, de sorte que le régime se rapproche pas à pas de la courbe des températures optimales.
 Dispositifs de contact d'étagère - l'un des types les plus courants de dispositifs de contact. Le principe de leur action est que le chauffage et le refroidissement du gaz entre les couches de catalyseur se trouvant sur les étagères sont effectués dans l'appareil de contact lui-même en utilisant divers liquides de refroidissement ou méthodes de refroidissement. Dans les appareils de ce type, la hauteur de chaque couche de catalyseur sous-jacente est plus élevée que celle située au-dessus, t .e. augmente le long du gaz et la hauteur des échangeurs de chaleur diminue, car à mesure que le degré global de conversion augmente, la vitesse de réaction diminue et la quantité de chaleur libérée diminue en conséquence. Le gaz frais circule séquentiellement de bas en haut dans l'espace annulaire des échangeurs de chaleur, refroidissant les produits de la réaction et se réchauffant à la température du début de la réaction
Dispositifs de contact d'étagère - l'un des types les plus courants de dispositifs de contact. Le principe de leur action est que le chauffage et le refroidissement du gaz entre les couches de catalyseur se trouvant sur les étagères sont effectués dans l'appareil de contact lui-même en utilisant divers liquides de refroidissement ou méthodes de refroidissement. Dans les appareils de ce type, la hauteur de chaque couche de catalyseur sous-jacente est plus élevée que celle située au-dessus, t .e. augmente le long du gaz et la hauteur des échangeurs de chaleur diminue, car à mesure que le degré global de conversion augmente, la vitesse de réaction diminue et la quantité de chaleur libérée diminue en conséquence. Le gaz frais circule séquentiellement de bas en haut dans l'espace annulaire des échangeurs de chaleur, refroidissant les produits de la réaction et se réchauffant à la température du début de la réaction
La productivité des dispositifs de contact en termes de H 2 SO 4, selon leur taille, varie de 50 à 500 tonnes par jour de H 2 SO 4. Conçu des dispositifs de contact avec une capacité de 1000 et 2000 tonnes par jour. 200 à 300 litres de masse de contact pour 1 tonne de production journalière sont chargés dans l'appareil. Les dispositifs de contact tubulaires sont utilisés pour oxyder le SO 2 moins souvent que ceux de type étagère. Pour l'oxydation de gaz sulfureux de concentration accrue, il est rationnel d'utiliser des dispositifs de contact avec des lits de catalyseurs fluidisés.
L'absorption d'anhydride sulfurique par la réaction SO 3 + H 2 O \u003d H 2 SO 4 +9200 J est généralement effectuée dans des tours avec une buse (Fig.3: 9,10), car les barboteurs ou les absorbeurs de mousse avec des charges de travail élevées ont une résistance hydraulique accrue. Si la pression partielle de vapeur d'eau sur l'acide absorbant est importante, alors le SO 3 se combine avec H 2 O en phase gazeuse et forme de minuscules gouttelettes de brouillard d'acide sulfurique insaisissable. Par conséquent, l'absorption est acides concentrés. La meilleure capacité d'absorption est un acide contenant 98,3% de H 2 SO 4 et ayant une élasticité négligeable à la fois de la vapeur d'eau et du SO 3. Cependant, pour un cycle dans la tour, il est impossible de fixer l'acide de 98,3% à un oléum standard contenant 18,5-20% d'anhydride sulfurique libre. En raison du grand effet thermique de l'absorption pendant le processus adiabatique dans la tour, l'acide se réchauffe et l'absorption s'arrête. Par conséquent, pour obtenir l'oléum, l'absorption est effectuée dans deux tours successivement installées avec une buse: la première d'entre elles est irriguée avec de l'oléum, et la seconde avec 98,3% d'acide sulfurique. Pour améliorer l'absorption, le gaz et l'acide entrant dans l'absorbeur sont refroidis, tandis que la force motrice du processus est augmentée.
Dans toutes les tours contacter la production, y compris les absorbeurs, la quantité d'acide d'irrigation est plusieurs fois supérieure à celle nécessaire à l'absorption des composants gazeux (H 2 O, SO 3) et est déterminée par le bilan thermique. Pour refroidir les acides en circulation, des réfrigérateurs d'irrigation sont généralement installés, dans les tuyaux desquels, irrigués avec de l'eau froide de l'extérieur, s'écoule l'acide refroidi.
La production d'acide sulfurique est grandement simplifiée en traitant le gaz obtenu en brûlant du soufre naturel pré-fondu et filtré, qui est presque exempt d'arsenic. Dans ce cas, le soufre pur est brûlé dans l'air, qui est préalablement séché avec de l'acide sulfurique dans une tour avec une buse. Il en résulte un gaz de 9% SO2 et 12% O2 à une température de 1000 ° C, qui est d'abord envoyé sous une chaudière à vapeur, puis sans nettoyage dans un appareil à contact. L'intensité de l'appareil est supérieure à celle du pyrite, en raison de la concentration accrue de SO2 et d'O2. Il n'y a pas d'échangeurs de chaleur dans l'appareil, car la température des gaz est réduite par l'ajout d'air froid entre les couches. L'absorption du SO3 s'effectue de la même manière que dans le schéma technologique.
Les tendances les plus importantes dans le développement de la production d'acide sulfurique par méthode de contact:
1) l'intensification des processus en les conduisant en couche suspendue, l'utilisation d'oxygène, la production et le traitement de gaz concentré, l'utilisation de catalyseurs actifs;
2) simplification des méthodes de nettoyage des gaz des poussières et des poisons de contact (organigramme plus court);
3) une augmentation de la puissance de l'équipement;
4) automatisation complète de la production;
5) la réduction des ratios de dépenses pour les matières premières et l'utilisation de déchets soufrés provenant de diverses industries comme matières premières;
6) neutralisation des gaz d'échappement.
La dynamique des coûts salariaux dans le développement du processus technologique
De manière générale, tous les documents ci-dessus peuvent être représentés comme suit:

On sait que ce processus et cette dynamique du travail se caractérisent par les formules suivantes:
Tl \u003d ---------------------- Tn \u003d 0,004 * t 2 +0,3 Tc \u003d Tl + Tn
La relation entre ces formules est la suivante:
Tp \u003d 0,004 * - 75 +0,3 et Tzh \u003d 21 * Tp-0,3 +1575
Sur la base des formules ci-dessus, nous effectuerons les calculs et les intégrerons dans un tableau général (Tableau 1):
| (Tab.1): Dynamique des coûts de main-d'œuvre dans la production d'acide sulfurique pendant 15 ans |
|||||||||||||||
| t (temps, années) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| Coût de la vie active | 0,78 | 0,75 | 0,71 | 0,654 | 0,595 | 0,54 | 0,48 | 0,43 | 0,38 | 0,34 | 0,3 | 0,27 | 0,24 | 0,22 | 0,198 |
| Coûts de main-d'œuvre antérieurs | 0,3 | 0,32 | 0,34 | 0,364 | 0,4 | 0,44 | 0,496 | 0,56 | 0,62 | 0,7 | 0,78 | 0,88 | 0,98 | 1,08 | 1,2 |
| Coût total | 1,09 | 1,07 | 1,04 | 1,018 | 0,995 | 0,98 | 0,976 | 0,98 | 1,01 | 1,04 | 1,09 | 1,15 | 1,22 | 1,3 | 1,398 |
Sur la base du tableau, nous construisons des graphiques des dépendances de Tl, Tn, Tc sur le temps (Fig. 7) et la dépendance de Tl sur Tn (Fig. 6) et Tn sur Tl (Fig. 8).

Ce graphique montre que ce processus est limité dans son développement.
La limite économique de l'accumulation de main-d'œuvre passée viendra dans sept ans.


Les graphiques 7 et 8 montrent que le type de processus économise du travail.
Calcul du niveau de technologie, de ces armes et de la productivité du travail vivant.
Le niveau de technologie est calculé par la formule:
Confort \u003d 1 / TJ * 1 / TP
Productivité du travail en direct:
L \u003d Pour ceux * B
L'équipement technique est calculé:
B \u003d TP / TJ
Niveau relatif de technologie:
Watnos \u003d Confort / L
Nous effectuerons des calculs en utilisant les formules ci-dessus et entrerons les données dans le tableau (Tableau 2):
| T Time (années) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| Coût de la vie active | 0,78 | 0,75 | 0,71 | 0,654 | 0,595 | 0,54 | 0,48 | 0,43 | 0,38 | 0,34 | 0,3 | 0,27 | 0,24 |
| Coûts de main-d'œuvre antérieurs | 0,3 | 0,32 | 0,34 | 0,364 | 0,4 | 0,44 | 0,496 | 0,56 | 0,62 | 0,7 | 0,78 | 0,88 | 0,98 |
| Coût total | 1,09 | 1,07 | 1,04 | 1,018 | 0,995 | 0,98 | 0,976 | 0,98 | 1,01 | 1,04 | 1,09 | 1,15 | 1,22 |
| Niveau technologique | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 |
| Tech. armement | 0,39 | 0,42 | 0,47 | 0,556 | 0,672 | 0,83 | 1,033 | 1,3 | 1,64 | 2,058 | 2,58 | 3,22 | 4 |
| Performance TJ | 1,28 | 1,33 | 1,41 | 1,529 | 1,68 | 1,86 | 2,083 | 2,34 | 2,62 | 2,94 | 3,29 | 3,68 | 4,1 |
| Niveau de technologie de relation | 3,29 | 3,16 | 2,98 | 2,747 | 2,5 | 2,25 | 2,016 | 1,8 | 1,6 | 1,429 | 1,28 | 1,14 | 1,02 |
Ce tableau montre que le développement rationnel n'est recommandé que pendant sept ans, car pendant cette période, le niveau relatif de technologie est supérieur à la productivité du travail vivant.
Conclusion
Dans cet article, la technologie de production de soufre par contact a été étudiée et décrite, la dynamique des coûts salariaux de la vie et du travail passé, ainsi que la dynamique des coûts salariaux au cours du développement du processus technologique sont analysées. Sur la base des travaux effectués, les conclusions suivantes ont été tirées: le développement de ces processus est limité, la limite économique d'accumulation du travail passé est de sept ans, ce processus technologique économise du travail et le développement rationnel est opportun pendant sept ans.
Littérature et sources:
1. PRODUCTION D'ACIDE SULFURIQUE / Baranenko D. http://service.sch239.spb.ru:8101/infoteka/root/chemistry/room1/baran/chem.htm
2. Technologie des industries les plus importantes: manuel. Pour éq. Spécial Universités / A.M. Ginberg, B.A. Khokhlov. - M.: École supérieure, 1985.




Étapes - préparation des matières premières et leur combustion ou cuisson. Leur contenu et leur conception matérielle dépendent de manière significative de la nature de la matière première, qui détermine dans une large mesure la complexité de la production technologique d'acide sulfurique. 1. Pyrite de fer. La pyrite de fer naturelle est une roche complexe composée de sulfure de fer ReB2, de sulfures d'autres métaux (cuivre, zinc, plomb, etc.), ...


Pas toujours faisable. Dans le même temps, les gaz d'échappement sont les matières premières les moins chères, les prix de gros de la pyrite sont également bas, tandis que le soufre est la matière première la plus chère. Par conséquent, pour que la production d'acide sulfurique à partir de soufre soit économiquement réalisable, il convient d'élaborer un schéma dans lequel le coût de son traitement sera nettement inférieur au coût de traitement des pyrites ou des déchets ...
![]()
Pour une régulation automatique, il est nécessaire de connaître autant que possible les exigences des différents procédés chimico-technologiques. 1. La partie principale 1.1 Le processus technologique d'obtention de l'anhydride sulfurique dans la production d'acide sulfurique. La production d'acide sulfurique de contact comprend les actions suivantes: 1. Déchargement, stockage et préparation des matières premières ...
L'acide nitrique se forme: NO (HSO4) + H2O®H2SO4 + HNO2. Il oxyde ensuite le SO2 selon l'équation: SO2 + 2HNO2®H2SO4 + 2NO.75% d'acide sulfurique s'accumule dans la partie inférieure des tours 1 et 2, naturellement, en plus grande quantité qu'il n'a été dépensé pour la préparation de la nitrosa (après tout, de l'acide sulfurique «nouveau-né» est ajouté). L'oxyde nitrique NO revient à nouveau à l'oxydation. Depuis un certain montant ...
Au 13ème siècle, l'acide sulfurique a été obtenu par grillage du sulfate de cuivre. D'où l'ancien nom de l'acide sulfurique - huile de vitriol. Depuis le XVIIIe siècle, l'acide sulfurique est obtenu par la méthode nitreuse, qui a été conservée à ce jour. Dans notre région a reçu de l'acide sulfurique. Dans notre pays, il existe 2 principales méthodes de production d'acide sulfurique: nitreuse et par contact. Selon l'une des méthodes, la première étape est l'oxydation des matières premières contenant du soufre avec de l'oxygène atmosphérique pour produire de l'oxyde de soufre (IV). Il est oxydé en SO3. Dans la méthode nitreuse, les catalyseurs sont des oxydes d'azote dans les tours en phase liquide. Sa concentration est de 75%. Il contient une grande quantité d'impuretés. Il est très bon marché et sert à la production d'engrais. Écologiquement, la production d'acide tour est très sale. Actuellement, de nouvelles usines ne sont plus construites, mais les anciennes usines existeront longtemps en raison du faible coût de l'acide résultant.
La méthode de contact utilise un catalyseur solide pour oxyder le SO2 en SO3. Dans la dernière étape, le S03 interagit avec l'eau pour former de l'acide sulfurique. Cette méthode est respectueuse de l'environnement.
La base théorique de la production d'acide sulfurique par méthode de contact.
Le processus comprend 4 étapes:
1. Cuisson de pyrite de soufre.
2. Purification du gaz de four à partir de poisons catalytiques.
3. Oxydation catalytique du SO2 en SO3.
4. Absorption de SO3 de 98% d'acide sulfurique ou d'oléum.
Obtenir SO2. Obtenu par torréfaction de la pyrite, qui fait partie des pyrites avec de l'oxygène de l'air.
4FeS2 + 11O2 --- (600-800С) ---\u003e 2Fe2O3 + 8SO2 + chaleur
Il s'agit d'une réaction hétérogène, à haute température, irréversible, non catalytique. Pendant la cuisson, l'oxyde de fer de soja se forme à la surface des particules de pyrite, ce qui inhibe la réaction d'oxydation. La vitesse de réaction hétérogène dépend de l'interface. Il est nécessaire de broyer la pyrite. Pendant le processus, l'épaisseur du film d'oxyde augmente constamment et empêche la poursuite de la réaction d'oxydation, le processus va dans la région intra-diffusion. Pour éliminer ces inhibitions de diffusion, la pyrite doit être broyée, tandis que l'épaisseur du film d'oxyde diminue automatiquement.
Lors de la transition vers des microbodies, des microparticules de pyrite à une température supérieure à 900 degrés commencent à fusionner avec la formation de grands agglomérats. Par conséquent, la température est limitée à 600-900 degrés.
Le processus de diffusion à la surface de la pyrite se déroule comme suit: les molécules d'oxygène s'écoulent à l'intérieur du grain de pyrite et réagissent avec la formation d'oxyde de fer et de SO2. Le SO2 résultant est désorbé des particules de pyrite pour former un nuage de SO2 autour de la particule, ce qui empêche la pénétration de l'oxygène dans la particule de pyrite. Pour éliminer cet inconvénient, les particules de pyrite doivent être mélangées vigoureusement.
Nettoyage de la cuisinière à gaz.
Le gaz de four résultant est d'abord refroidi à partir de la majeure partie de la poussière dans le cyclone, après refroidissement .....
Après refroidissement, le gaz du four contient une grande quantité d'impuretés - sélénium, arsenic, oxydes de fer, humidité, etc.
De nombreuses impuretés sont des poisons de contact pour l'oxydation du SO2 en SO3. Par conséquent, le nettoyage et le séchage du gaz du four sont nécessaires.
À ce jour, seul un nettoyage humide peut être effectué efficacement.
Les impuretés nocives sont séquentiellement absorbées par 70%, 35%, 5% d'acide sulfurique et de l'eau. Après cela, l'acide sulfurique produit est séché, qui est ensuite sélectionné comme produit commercial.
Situation problématique: au stade du nettoyage, le gaz du four est refroidi, humidifié et au stade suivant, il devra être chauffé à haute température et vidangé.
Oxydation du SO2 en SO3.
Il s'agit d'une réaction réversible catalytique exothermique, procédant à une diminution de volume.
2SO2 + O2 \u003d 2SO3 + Q
Selon le principe du Chatelier, elle doit être réalisée à basse température et haute pression. Actuellement, ce procédé est réalisé sans appliquer de pression en raison de la forte concentration de lest d'azote.
Sans catalyseur, cette réaction ne va pratiquement pas. Les catalyseurs suivants sont utilisés - le platine - il est très actif, mais très catalyseur, il est très empoisonné par les poisons de contact; oxyde de vanadium - actif à une température de 400-600 degrés, les sabots sont gravés avec des poisons de contact, est le principal catalyseur; l'oxyde de fer 3 est bon marché, il n'est pas gravé par les poisons de contact, mais il est actif à des températures supérieures à 625 degrés, auxquelles le degré de conversion d'équilibre ne peut pas être supérieur à 70%. Il est utilisé pour la pré-oxydation du SO2 en SO3 avec une conversion de 50 à 60%.
L'effet de la température.
Pendant le processus d'oxydation, de la chaleur est générée en continu, ce qui entraîne une augmentation continue de la température dans le réacteur. Afin de résister à la température dans le réacteur, le réacteur est à plusieurs étages et la chaleur est éliminée après chaque étape.
Degré d'équilibre de conversion. Afin de déplacer le degré d'équilibre vers la droite et d'atteindre un degré de conversion total proche de 100%, un système DK / YES a été développé - double contact et double absorption. Après la première étape de mise en contact (1 à 3 plateaux de réacteur, 5 au total), le gaz de contact est absorbé pour extraire le SO3 qui en est issu. Le degré de conversion d'équilibre à ce stade est de 93%. Le SO2 restant est renvoyé dans le réacteur au 2e stade de mise en contact (4 à 5 plateaux de réacteur), où encore 93% du SO2 est converti en SO3. Et puis passe à la deuxième étape de l'absorption. Le degré de conversion total est de: 99,5%.
Absorption d'oxyde de soufre VI.
SO3 + H2O -\u003e H2SO4 + Q
En raison de la possibilité de formation de buée ... l'eau ne peut pas être utilisée comme absorbant; 98% d'acide sulfurique (pression de vapeur 0) ou 19% d'oléum est utilisé.
Cette réaction est hétérogène, une augmentation de l'interface entre les phases gazeuse et liquide est donc nécessaire. Pour ce faire, des plaques et une très haute densité d'irrigation sur colonne sont utilisées. L'irrigation est réalisée par 19% oléum, recevoir 20% oléum. Cette réaction peut être effectuée en phase vapeur à très grande vitesse, alors qu'il est nécessaire de précipiter un brouillard d'acide sulfurique sur des précipitateurs électrostatiques.
La conception de l'équipement est grandement simplifiée.
L'absorption est pratiquement irréversible à des températures supérieures à 500 degrés.
Le schéma technologique pour la production d'acide sulfurique par la méthode de contact DC / YES.
Recevez une méthode continue en 4 étapes.
1. Oxydation des pyrites de soufre avec l'oxygène atmosphérique en oxyde de soufre 4.
2. Nettoyage humide des oxydes de soufre 4 des poisons de contact.
3. Oxydation par contact de l'oxyde de soufre 4 en oxyde de soufre 6 sur un catalyseur hétérogène au vanadium.
4. Absorption d'oxyde de soufre 6 98% d'acide sulfurique et d'oléum.
Dans le four à lit 1, les pyrites de soufre broyées et l'air sont alimentés en continu (excès 1,5). Le gaz de four obtenu est nettoyé de la poussière dans le cyclone 2, refroidi dans une chaudière à chaleur perdue 3, passe un précipitateur électrostatique 4 pour éliminer les résidus de poussière et passe ensuite au nettoyage humide. Le nettoyage humide coûte cher, mais seulement aujourd'hui, il est capable de nettoyer le gaz du four des poisons de contact - oxydes de sélénium, d'arsenic, de vapeur d'eau. Le nettoyage humide est effectué dans les tours de lavage, les précipitateurs électrostatiques humides et les tours de séchage. Pour ce faire, le gaz de fournaise passe successivement par les tours de lavage 5, 6, 8 qui sont irriguées avec 70% d'acide sulfurique (5), 35% d'acide sulfurique (6), 5% d'acide sulfurique et de l'eau (8). Après les tours 6 et 8, des précipitateurs électrostatiques humides sont installés. 7 et 9. L'acide sulfurique à 75% sortant du bas de la tour de lavage 5 va à l'allocation des boues, à partir desquelles le sélénium et l'arsenic sont isolés. Le sélénium sert à la production de semi-conducteurs. 75% d'acide, ainsi que des solutions aqueuses d'acide sulfurique, qui sont évacuées des colonnes 6 et 8 et des précipitateurs électrostatiques 7 et 9 vont à la production d'engrais minéraux. Les précipitateurs électrostatiques 7 et 9 sont utilisés pour détruire le brouillard d'acide sulfurique. Le gaz de four ainsi purifié du précipitateur électrostatique 9 pénètre dans la partie inférieure de la colonne d'absorption 10, où le gaz de four est séché à l'aide d'acide à 96-98%. L'acide sulfurique des produits avec une concentration de 93 à 95% est évacué par le bas de la colonne.
Le gaz de four purifié et séché à travers un compresseur 11 est envoyé à travers un filtre 12 à un système d'échangeur de chaleur (13 et 14) pour être chauffé à une température de 400 degrés et envoyé à un appareil de contact 15, composé de 5 couches de catalyseur. Les 3 premières couches sont utilisées pour la première étape de mise en contact, 4 et 5 pour la deuxième étape de mise en contact. La concentration initiale de SO2 dans le gaz du four est de 10%. Le chauffage du gaz de four dans les échangeurs de chaleur 13 et 14 est effectué par du gaz de contact, qui est prélevé après 1 et 3 couches de catalyseur. Le degré de conversion du SO2 en SO3 sur le premier lit de catalyseur atteint 70%, la température du gaz de contact monte à 600 degrés. Il traverse l'espace tubulaire de l'échangeur de chaleur 14 et avec une température de 400 degrés pénètre dans le lit de catalyseur 2. Après 2 couches, le gaz de contact est refroidi dans l'échangeur de chaleur 18 et entre dans la couche 3 de catalyseur. Après cela, le gaz de contact est refroidi dans l'espace tubulaire de l'échangeur de chaleur 13 et envoyé au premier étage d'absorption pour récupérer le SO3 résultant. L'absorption est réalisée séquentiellement dans 2 absorbeurs 16 et 17. 16 l'absorbeur est irrigué en partie haute avec 19% oléum, 20% oléum est évacué par le bas. Il s'agit du produit principal de l'installation. À partir de l'absorbeur 16, le gaz de contact est ensuite envoyé vers la partie inférieure de l'absorbeur 17, qui est irriguée avec de l'acide sulfurique à 98%. Le fond 17 rejette environ 100% d'acide sulfurique, qui est utilisé pour le séchage. Après extraction du SO3 de l'absorbeur 17, le gaz de contact est envoyé vers la deuxième étape de mise en contact dans le réacteur 15, vers la couche de catalyseur 4 et 5.
Le gaz de contact est chauffé dans des échangeurs de chaleur de 20, 19, 18 à 400 degrés et entre dans le lit de catalyseur 4. Après cela, le gaz est refroidi dans l'échangeur de chaleur 20 et entre dans le 5ème lit de catalyseur. Après le 5ème lit de catalyseur, le gaz de contact est refroidi dans l'échangeur de chaleur 19 et envoyé à l'absorption dans l'absorbeur 21, qui fonctionne de manière similaire à l'absorbeur 17.
Le gaz inverse avec une teneur en oxyde de soufre inférieure à 0,1% est soit émis dans l'atmosphère, soit fourni pour une purification ultérieure dans les grandes usines. Les oxydes de soufre sont soit convertis en un mélange de sulfites ou de sulfates, soit réduits en soufre élémentaire.
Cette méthode de production d'acide sulfurique DK / YES est aujourd'hui techniquement une voie moderne. Cependant, il a des défauts.
Au stade du nettoyage humide, il est nécessaire de refroidir et d'hydrater, et pour l'étape suivante, il est nécessaire de drainer et de chauffer.
Actuellement, une nouvelle méthode de production d'acide sulfurique est développée - l'acide sulfurique spécial.
Le gaz de four résultant, après nettoyage dans des précipitateurs électrostatiques secs, est envoyé vers un appareil de contact avec des catalyseurs spéciaux, qui n'a pas peur des poisons de contact et de la vapeur d'eau. Le gaz de contact résultant est ensuite envoyé pour être absorbé par l'eau en phase vapeur. Il apprend immédiatement acide sulfurique sous forme de brouillard, qui se dépose sur de puissants précipitateurs électrostatiques. Il existe des variantes de ce système où l'étape de catalyse préliminaire est utilisée pour détruire les poisons de contact.
Considérez le processus de production d'acide sulfurique par la méthode de contact à partir de pyrites sulfuriques (fer). La première étape du processus est l'oxydation des pyrites avec l'obtention de gaz de combustion contenant du dioxyde de soufre.
La combustion de pyrites (pyrite) est un processus physique et chimique complexe et comprend un certain nombre de réactions se déroulant séquentiellement ou simultanément:
Dissociation thermique 2FeS 2 \u003d 2FeS + S 2;
Combustion en phase vapeur du soufre S 2 + 2О 2 \u003d 2SO 2;
Brûlage de pyrrhotite 4FeS + 7О 2 \u003d 2Fе 2 О 3 + 4SО 2.
La réaction totale: 4FеS 2 + 11O 2 \u003d 2Fе 2 О 3 + 8SO 2. (Je)
Avec un léger excès ou un manque d'oxygène, un oxyde de fer mixte se forme:
3FеS 2 + 8О 2 \u003d Fe 3 О 4 + 6SО 2.
La décomposition thermique de la pyrite commence déjà à une température d'environ 200 ° C et le soufre s'enflamme simultanément. À des températures supérieures à 680 ° C, les trois réactions se déroulent de manière intensive. Dans l'industrie, la cuisson s'effectue à 850 - 900 ° C. L'étape limite du processus est le transfert de masse des produits de décomposition dans la phase gazeuse et l'oxydant vers le site de réaction. Aux mêmes températures, le composant solide se ramollit, ce qui contribue à l'adhésion de ses particules.
Ainsi, au cours de la réaction (I), en plus du produit gazeux de la réaction SO 2, il se forme le produit solide Fe 2 O 3 qui peut être présent en phase gazeuse sous forme de poussières. La pyrite contient diverses impuretés, en particulier des composés d'arsenic et de fluor, qui lors du processus de cuisson passent en phase gazeuse. La présence de ces composés dans l'étape d'oxydation par contact du dioxyde de soufre peut provoquer un empoisonnement du catalyseur. Par conséquent, le gaz de réaction après l'étape de cuisson à la pyrite doit être dirigé de manière préliminaire vers l'étape de préparation pour l'oxydation de contact (deuxième étape), qui, en plus de la purification des poisons catalytiques, comprend la libération de vapeur d'eau (séchage), ainsi que la production de sous-produits (Ce et Te).
Dans la troisième étape, une réaction chimique exothermique réversible d'oxydation par contact du dioxyde de soufre se déroule:
SO 2 + 1 / 2O 2 ↔ SO 3
Divers métaux, leurs alliages et oxydes, certains sels, silicates et de nombreuses autres substances ont la capacité d'accélérer l'oxydation du SO2. Chaque catalyseur en fournit un certain degré de conversion. Dans les conditions d'usine, il est plus avantageux d'utiliser des catalyseurs, à l'aide desquels le plus grand degré de conversion est atteint, car la quantité résiduelle de SO 2 non oxydé n'est pas capturée dans le compartiment d'absorption, mais est éliminée dans l'atmosphère avec les gaz d'échappement.
Pendant longtemps, le meilleur catalyseur pour ce processus a été le platine, qui, à l'état finement divisé, a été appliqué à l'amiante fibreux, au gel de silice ou au sulfate de magnésium. Cependant, le platine, bien qu'il ait l'activité catalytique la plus élevée, est très cher. De plus, son activité est fortement réduite en présence des plus petites quantités d'arsenic, de sélénium, de chlore et d'autres impuretés dans le gaz. Par conséquent, l'utilisation d'un catalyseur au platine a entraîné une complication de la conception du matériel en raison de la nécessité d'une purification approfondie du gaz et a augmenté le coût du produit fini.
Parmi les catalyseurs autres que le platine, le catalyseur au vanadium (à base de pentoxyde de vanadium V 2 O 5) a l'activité catalytique la plus élevée; il est moins cher et moins sensible aux impuretés que le catalyseur au platine.
La réaction d'oxydation du SO 2 est exothermique; son effet thermique, comme toute réaction chimique, dépend de la température. Dans la plage de 400 à 700 ° C, l'effet thermique de la réaction d'oxydation (en kJ / mol) peut être calculé avec la précision suffisante pour les calculs techniques par la formule
Q \u003d 10142 -9,26T ou 24205 - 2,21T (en kcal / mol)
où T- température, K.
La réaction d'oxydation du SO 2 en SO 3 est réversible. La constante d'équilibre de cette réaction (en Pa -0,5) est décrite par l'équation
où Pso 3, Pso 2, Po 2 sont les pressions partielles d'équilibre de SO 3, SO 2 et O 2, Pa.
Valeur Krdépend de la température. Les valeurs de K p dans la plage
390-650 ° C peut être calculé par la formule
logK p \u003d 4905 / T - 7.1479
Le degré de conversion du SO 2 atteint sur le catalyseur dépend de son activité, de la composition gazeuse, de la durée du contact gazeux avec le catalyseur, de la pression, etc. Pour un gaz de cette composition, le plus théoriquement possible, c'est-à-dire que le degré d'équilibre de conversion dépend de la température et s'exprime par l'équation

Dans des conditions industrielles, le taux d'oxydation du SO 2 est essentiel. Le taux de cette réaction dépend de la quantité de dioxyde de soufre oxydé par unité de temps par unité de masse du catalyseur, et, par conséquent, de la consommation de catalyseur, des dimensions de l'appareil de contact et d'autres indicateurs techniques et économiques du procédé. On cherche à conduire le procédé de sorte que la vitesse d'oxydation du SO 2, ainsi que le degré de conversion soient éventuellement plus élevés.
La vitesse d'oxydation du SO 2 est caractérisée par une constante de vitesse

où k 0 -coefficient; E- énergie d'activation, J / mol; R- constante de gaz universelle, 8,31 J / (mol-K); T- température absolue, K.
De la théorie cinétique des gaz, on sait que la proportion de molécules possédant une énergie suffisante pour assurer qu'une réaction se produise lors de leur collision est, pour une première approximation e~ E / RT . Ainsi, ce terme dans l'équation de la vitesse de réaction caractérise la fraction de collisions efficaces conduisant à la formation de molécules de SO 3. Exposant dans l'expression e~ Elrt négatif par conséquent, avec l'augmentation de la température, la vitesse de réaction augmente, et avec l'augmentation Ediminue.
Énergie d'activation Ela réaction d'oxydation du SO 2 en SO 3 est très importante, par conséquent, sans catalyseur, la réaction d'oxydation homogène ne se produit pratiquement pas même à haute température. En présence de catalyseurs solides, l'énergie d'activation diminue, par conséquent, la vitesse de la réaction catalytique hétérogène augmente. Ainsi, le rôle du catalyseur est d'abaisser l'énergie d'activation E.
La dernière étape du processus est l'absorption du trioxyde de soufre par l'acide sulfurique concentré ou l'oléum.
Les différentes étapes de production d'acide sulfurique peuvent être combinées de différentes manières dans l'organigramme du processus. Dans la fig. 1 est un diagramme schématique d'un procédé de production d'acide sulfurique à partir de pyrites selon un circuit ouvert avec la mise en contact dite unique.
La tâche la plus importante dans la production d'acide sulfurique est d'augmenter le degré de conversion du SO 2 en SO 3. En plus d'augmenter la productivité de l'acide sulfurique, cette tâche peut également résoudre les problèmes environnementaux - réduire les émissions du composant nocif SO 2 dans l'environnement.
L'augmentation du degré de conversion du SO 2 peut être obtenue de différentes manières. Le plus commun d'entre eux est la création de schémas à double contact et à double absorption (DCDA).

Fig.1. Diagramme fonctionnel de la production d'acide sulfurique à partir de pyrites par la méthode du contact unique.
Une autre solution possible au même problème consiste à conduire le processus dans un schéma cyclique (fermé) en utilisant de l'oxygène technique.
Il convient de noter que le schéma de circuit illustré à la Fig. 1 n'est qu'un schéma préliminaire qui ne contient pas une grande quantité d'informations. Par exemple, il ne reflète pas le transfert de chaleur entre les flux individuels, qui est nécessaire pour un schéma énergétique, n'indique pas les types d'appareils utilisés dans chaque unité, etc. Il est possible de résoudre ces problèmes en analysant les caractéristiques physico-chimiques et technologiques des différentes étapes du processus.
D'après les données de la fig. 1 diagramme schématique suit qu'il peut distinguer quatre grandes étapes principales:
1) obtenir un gaz de calcination contenant du dioxyde de soufre;
2) préparation du gaz de combustion pour l'oxydation par contact;
3) oxydation catalytique du dioxyde de soufre;
4) l'absorption du trioxyde de soufre.
Avec une conception technologique différente, certains détails de ces étapes, en particulier l'étape 2, différeront, cependant, l'approche principale de leur mise en œuvre et le choix du mode technologique dépend des tâches qui sont résolues à l'étape considérée, et seront les mêmes dans différents processus spécifiques de production d'acide sulfurique.

