क्या लोहे के यौगिक पानी में घुलनशील हैं। लोहे के रासायनिक और भौतिक गुण
चार टेस्ट ट्यूब में एसिड की 5-6 बूंदें डालें: 2 एन एचसीएल समाधान, 2 एन एच 2 एसओ 4 समाधान, केंद्रित एच 2 एसओ 4, 2 एन नाइट्रिक समाधान। प्रत्येक ट्यूब में, लोहे की छीलन (या एक पेपर क्लिप) का एक टुकड़ा जोड़ें। केंद्रित सल्फ्यूरिक एसिड के साथ ट्यूब को गरम करें। फिर सभी समाधानों में पोटेशियम या अमोनियम थायोसाइनेट (केसीएनएस या एनएच 4 सीएनएस) के 0.01 एन समाधान के एक बूंद को मिलाएं, जो Fe (CNS) 3 नमक का निर्माण करता है, जो लोहे के साथ लाल रंग में तीव्रता से रंगा होता है (III) आयनों। Fe 3+ आयनों का निर्माण किस अम्ल में होता है?
उन एसिड में जहां घोल लाल नहीं हुआ, Fe 2+ आयन लोहे के विघटन पर बनते हैं।
विभिन्न अम्लों में लोहे के विघटन की प्रतिक्रियाओं को जोड़ना और बराबर करना और उनमें से प्रत्येक में ऑक्सीकरण एजेंट को इंगित करना:
a) Fe + HCl® H 2 + ........
b) Fe + H 2 SO 4 (विघटित) ® H 2 + ........
c) Fe + H 2 SO 4 (conc) ® SO 2 + H 2 O + ........
d) Fe + HNO 3 (विघटित) ® NO + H 2 O + .......
अनुभव 2. लोहा प्राप्त करना (II) हाइड्रॉक्साइड और इसके गुणों का अध्ययन।
लोहे के लवण (II) हवा में आंशिक ऑक्सीकरण के कारण हमेशा लोहे (III) आयन होते हैं। इसलिए, लोहे (II) के गुणों का अध्ययन करने के लिए, मोरा क्रिस्टलीय नमक को ऑक्सीकरण / (NH 4) 2 SO 4 × Fe (SO 4) × 6H 2 O / के लिए सबसे प्रतिरोधी लेना चाहिए और 5 में कई क्रिस्टल रखकर प्रत्येक प्रयोग के लिए एक नया समाधान तैयार करना चाहिए। -6 बूंद पानी।
हौसले से तैयार मोहर के नमक की दो बूंदों को तीन परीक्षण ट्यूबों में डालें और 2 सेंट क्षारित (Fe) के हरे-भूरे रंग के अवक्षेप होने तक 2N क्षार घोल (NaOH) डालें। अवक्षेप के साथ ट्यूबों में से एक में, 2 एन हाइड्रोक्लोरिक एसिड समाधान जोड़ें जब तक कि यह घुल न जाए। लोहा (II) हाइड्रॉक्साइड प्रदर्शन के कौन से गुण (अम्लीय या मूल) है? कई मिनट के लिए हवा में दूसरी ट्यूब में गोली छोड़ दें, समय-समय पर ट्यूब को मिलाते हुए। तीसरे टेस्ट ट्यूब में हाइड्रोजन पेरोक्साइड (H 2 O 2) के 3% घोल की 2-3 बूंदें डालें। लोहे (III) क्लोरोक्साइड के गठन के कारण दूसरे और तीसरे परीक्षण ट्यूबों में हरे रंग से भूरे रंग के लिए अवक्षेप के रंग परिवर्तन पर ध्यान दें। ऑक्सीकरण कब तेजी से हुआ? सभी प्रतिक्रियाओं के समीकरण लिखें: ए) लोहा (द्वितीय) हाइड्रॉक्साइड प्राप्त करना; बी) हाइड्रोक्लोरिक एसिड में उपजी Fe (OH) 2 को भंग करना; c) Fe (OH) 2 का Fe (OH) 3 में ऑक्सीकरण, पानी की भागीदारी के साथ वायुमंडलीय ऑक्सीजन के साथ; डी) हाइड्रोजन पेरोक्साइड के साथ Fe (OH) 2 का ऑक्सीकरण।
अनुभव 3. अम्लीय वातावरण में लोहे (द्वितीय) के कम करने वाले गुण।
पोटेशियम परमैंगनेट (KMnO 4) के घोल की 3 बूंदों और सल्फ्यूरिक एसिड के 2N घोल की 2 बूंदों को टेस्ट ट्यूब में डालें। समाधान के लिए मोहर के नमक के कुछ क्रिस्टल जोड़ें। विरंजन क्यों होता है? इस प्रतिक्रिया में कम करने वाला एजेंट क्या है? प्रतिक्रिया समीकरण जोड़ें:
KMnO 4 + H 2 SO 4 + FeSO 4® MnSO 4 + K 2 SO 4 + H 2 O + .....
अनुभव 4. लोहा प्राप्त करना (III) हाइड्रॉक्साइड और इसके गुणों का अध्ययन।
2 ट्यूबों में एक लोहे (III) नमक (FeCl 3 या Fe 2 (SO 4) 3) के घोल की 2 बूंदें जोड़ें और 2N NaOH के घोल को तब तक घोलें जब तक कि एक अवक्षेप (रंग का निशान) न हो जाए। एक ट्यूब में एचसीएल या एच 2 एसओ 4 के 2 एन समाधान के 5-6 बूंदों को डालें और दूसरे में 2 एनएचओएच समाधान की 2 बूंदों की समान मात्रा। तलछट कहाँ भंग हुई? लोहा (III) हाइड्रॉक्साइड में कौन से गुण (मूल या एम्फोटेरिक) होते हैं? प्रतिक्रिया समीकरण लिखें।
अनुभव 5. लोहे के ऑक्सीकरण गुण (III)।
लोहे (III) नमक के 3 बूंदों के साथ एक परखनली में, पोटेशियम आयोडाइड (KI) के घोल की 1-2 बूंदें डालें। समाधान के रंग परिवर्तन पर ध्यान दें। Fe 3+ आयन क्या गुण प्रदर्शित करता है? प्रतिक्रिया का समीकरण लिखिए, यह देखते हुए कि प्रतिक्रिया उत्पादों में से एक I 2 है।
अनुभव 6. लोहे के लवणों की हाइड्रोलिसिस (II) और लोहा (III)
सार्वभौमिक संकेतक के दो स्ट्रिप्स को एक ग्लास स्लाइड पर रखें और मोहर के नमक और लोहे (III) क्लोराइड (अलग से) के समाधान की 1 बूंद लागू करें। इन लवणों के विलयन का pH ज्ञात कीजिए। पहले चरण में इन लवणों की हाइड्रोलिसिस प्रतिक्रियाओं के समीकरण (आयनिक) लिखें। कौन सा नमक अधिक हद तक हाइड्रोलाइज्ड है? लोहे का कौन सा हाइड्रोक्साइड (II) या लोहा (III) में अधिक बुनियादी गुण हैं?
अनुभव 7. लोहे के आयनों के लिए गुणात्मक प्रतिक्रियाएं।
a) आयरन (II) आयनों की प्रतिक्रिया
मोरा नमक के घोल की 2-3 बूंदों में पोटेशियम हेक्सासानोफेरेट (III) (K 3) की 1 बूंद डालें। केएफई तलछट के रंग को चिह्नित करें। प्रतिक्रिया समीकरण लिखें।
ख) एक लोहे (III) आयन के लिए प्रतिक्रिया
लोहे (III) क्लोराइड के घोल की 2-3 बूंदों में पोटेशियम थायोसाइनेट (केसीएनएस) या अमोनियम (एनएच 4 सीएनएस) के एक पतला घोल की 1 बूंद डालें। लोहे के परिणामस्वरूप समाधान के रंग को चिह्नित करें (III) रोडानाइड। प्रतिक्रिया समीकरण लिखें।
अनुभव 8. कोबाल्ट (II), निकल (II) और उनके गुणों के अध्ययन के हाइड्रॉक्साइड प्राप्त करना।
ए) कोबाल्ट नमक समाधान (CoCl 2) की 2-3 बूंदें दो परीक्षण ट्यूबों (रंग को चिह्नित करें) और प्रत्येक ड्रॉपवाइज में क्षार समाधान जोड़ें। सबसे पहले, Co (OH) Cl के मूल नमक का एक नीला अवक्षेप दिखाई देता है, जो तब कोबाल्ट (II) हाइड्रॉक्साइड (Co (OH) 2) के बनने के कारण रंग बदलकर गुलाबी हो जाता है। चरणों में कोबाल्ट (II) हाइड्रोक्साइड के गठन के लिए प्रतिक्रिया समीकरण लिखें। एक ट्यूब में गोली को हिलाएं और इसे हवा में कई मिनट तक छोड़ दें। दूसरे टेस्ट ट्यूब में वेग के लिए 3% हाइड्रोजन पेरोक्साइड घोल की 2-3 बूंदें मिलाएं। तलछट के रंग में परिवर्तन पर ध्यान दें। वायुमंडलीय ऑक्सीजन और हाइड्रोजन पेरोक्साइड (H 2 O 2) के साथ Co (OH) 2 से Co (OH) 3 के ऑक्सीकरण के लिए समीकरण लिखिए। ऑक्सीकरण कब तेज होता है?
बी) 2-3 ट्यूबों में निकल नमक (रंग) के घोल की 2-3 बूंदें डालें और ड्रॉप द्वारा क्षार घोल डालें जब तक कि निकेल (II) हाइड्रॉक्साइड प्रीसिपिटेट्स (रंग) का एक अवक्षेपण नहीं हो जाता। विभिन्न ऑक्सीकरण एजेंटों के साथ परिणामी हाइड्रोक्साइड को ऑक्सीकरण करने का प्रयास करें। ऐसा करने के लिए, हवा में पहली टेस्ट ट्यूब में अवक्षेप छोड़ दें, दूसरी टेस्ट ट्यूब में Н 2 О 2 के 3% घोल की 2-3 बूंदें डालें, और तीसरे टेस्ट ट्यूब में ब्रोमिन वाटर (Br 2 + H 2 O) की 1 बूंद डालें। किस ट्यूब में अवक्षेप का रंग देखा जाता है, अर्थात Ni (OH) 2 का Ni (OH) 3 का ऑक्सीकरण है? निकल (II) हाइड्रॉक्साइड और निकल (III) हाइड्रॉक्साइड के उत्पादन के लिए प्रतिक्रिया समीकरणों को जोड़ने के लिए:
NiSO 4 + NaOH® Na 2 SO 4 + .....
नी (OH) 2 + Br 2 + NaOH® NaBr + H 2 O + ...
सुरक्षा के सवाल।
1 .. लोहे, कोबाल्ट, निकल के परमाणुओं के इलेक्ट्रॉनिक सूत्र लिखें।
2. ऑक्सीकरण की कौन सी डिग्री लोहा, कोबाल्ट, निकल के तत्वों के परमाणुओं की विशेषता है?
3. Fe (OH) 2, Co (OH) 2 या Ni (OH) 2 में से कौन सा पदार्थ एक मजबूत कम करने वाला एजेंट है? निष्कर्ष वायुमंडलीय ऑक्सीजन, एच 2 ओ 2 और ब्र 2 के साथ इन हाइड्रॉक्साइडों की प्रतिक्रियाओं के आधार पर तैयार किया गया है। (श्रृंखला 2 O® H 2 O 2® Br 2 श्रृंखला में ऑक्सीकरण एजेंट की ताकत बढ़ जाती है)।
4. प्रतिक्रिया समीकरणों को लिखें जिसके द्वारा Fe 2+ और Fe 3+ आयनों के बीच अंतर करना संभव है।
5. धात्विक लोहे से लोहा (II) नमक कैसे प्राप्त करें? प्रतिक्रिया समीकरण लिखें।
6. धात्विक लोहे से लोहा (III) नमक कैसे प्राप्त करें? प्रतिक्रिया समीकरण लिखें।
7. कौन सा लौह नमक अधिक हाइड्रोलाइज्ड है: FeCl 2 या FeCl 3? हाइड्रोलिसिस प्रतिक्रियाओं के समीकरण लिखिए। इन लवणों के समाधान की प्रतिक्रिया क्या है?
8. लोहे (II) नमक को लोहे (III) नमक में कैसे बदलें? इस तरह के एक संक्रमण का एक उदाहरण दें।
9. लोहे (III) के नमक को लोहे (II) में कैसे परिवर्तित करें? इस तरह की प्रतिक्रिया का एक उदाहरण दें।
10. क्या वे सह-कलाकार हो सकते हैं: ए) फे (ओएच) 2 और एच 2 ओ 2?
b) नी (OH) 2 और H 2 O 2? क्यों? यदि कोई प्रतिक्रिया है, तो इसे लिखें।
11. क्या वे सह-कलाकार हो सकते हैं: ए) नी (ओएच) 2 और ब्र 2?
b) FeCl 3 और KI? यदि प्रतिक्रियाएं हैं, तो उन्हें लिखें।
12. वायुमंडलीय ऑक्सीजन द्वारा हाइड्रॉक्साइड Fe (OH) 2 या Ni (OH) 2 को क्या ऑक्सीकृत किया जा सकता है? यदि प्रतिक्रिया जारी है, तो इसे लिखें।
13. मिश्र धातु की एक साफ सतह पर 1-2 बूंदें लगाई जाती हैं केंद्रित एसिड और 2-3 मिनट के बाद। KCNS समाधान के साथ सिक्त फिल्टर पेपर बूंद पर लागू किया गया था। कागज पर एक लाल धब्बा दिखाई दिया। मिश्र धातु में कौन सी धातु मौजूद है? एक प्रतिक्रिया लिखें।
14. प्रयोगशाला में सह (OH) 3 और Ni (OH) 3 कैसे प्राप्त किए जा सकते हैं? प्रतिक्रिया समीकरण लिखें।
15. जब क्लोरीन को लोहे (III) के साथ संतृप्त किया जाता है, तो पोटेशियम हाइड्रॉक्साइड के घोल में निलंबित हाइड्रॉक्साइड, पोटेशियम फेरेट का निर्माण होता है। प्रतिक्रिया समीकरण लिखें।
16. प्रतिक्रिया समीकरणों को लिखें: ए) बेरियम फेरेट और केंद्रित के बीच हाइड्रोक्लोरिक एसिड; बी) पोटेशियम फेरेट और पोटेशियम आयोडाइड के बीच।
17. लोहे के घोल (II) सल्फेट के घोल में सोडियम कार्बोनेट का घोल डालने पर क्या होता है; b) लोहे (III) सल्फेट के घोल में? गठित उत्पादों की प्रकृति में अंतर का क्या कारण है? प्रतिक्रिया समीकरण लिखें।
18. लोहे (II) क्लोराइड: b) के घोल पर लोहे (II) क्लोराइड के घोल पर सोडियम सल्फाइड (a) के विलयन की क्रिया के तहत होने वाले अभिक्रिया समीकरण लिखिए। क्या अवक्षेप को अधिक हाइड्रोक्लोरिक एसिड में भंग किया जा सकता है?
19. कार्बन मोनोऑक्साइड के साथ कौन से यौगिक लोहे, कोबाल्ट, निकल बनाते हैं? वे उन्हें किन परिस्थितियों में प्राप्त करते हैं?
20. फेराइट के उत्पादन के लिए प्रतिक्रियाओं का उदाहरण दें। सोडियम फेराइट में अतिरिक्त पानी मिलाने पर क्या होता है। प्रतिक्रिया समीकरण लिखें।
गैर-धातुओं की रसायन शास्त्र
बोरॉन (बी) और एल्यूमीनियम आवधिक प्रणाली के समूह III के मुख्य उपसमूह में शामिल हैं। परमाणुओं की बाहरी इलेक्ट्रॉन परत पर तीन इलेक्ट्रॉन होते हैं:
चूँकि बोरोन के पारिश्रमिक स्तर पर केवल दो इलेक्ट्रॉन होते हैं, इसलिए इसके गुण तेजी से उपसमूह के अन्य तत्वों के गुणों से भिन्न होते हैं - यह III ए उपसमूह में एकमात्र गैर-धातु है। हालांकि औपचारिक रूप से बोरान ऑक्साइड और हलाइड्स में +3 के ऑक्सीकरण राज्य को प्रदर्शित करता है, आयन बी +3 अज्ञात है। एक उत्तेजित बोरॉन परमाणु के तीन एसपी 2-हाइब्रिड बादल, अधातु के साथ सहसंयोजक बंधों के निर्माण में शामिल होते हैं, इसलिए, +3 के ऑक्सीकरण राज्य वाले बोरान यौगिकों में एक सपाट - त्रिकोणीय संरचना होती है।
धातुओं के साथ यौगिकों में - बोराइड्स - बोरॉन एक इलेक्ट्रॉन स्वीकर्ता है: Mg 3 B 2, AlB, आदि।
सामान्य परिस्थितियों में, एक साधारण पदार्थ बोरॉन है - एक ठोस पदार्थ (टी पीएल \u003d 2075 डिग्री सेल्सियस)। बोरॉन की क्रिस्टल संरचना विशेष है। यह धातुओं या गैर-धातुओं की विशेषता नहीं है। यह बड़ी संख्या में बॉन्ड (\u003e 4) को लागू करता है, जिसकी प्रकृति न तो आमतौर पर धातु है और न ही सामान्य सहसंयोजक है। एक बोरान क्रिस्टल में आइसोसाहेड्रोन होते हैं - 12 टांके के साथ नियमित ट्वेंटाहेड्रा। साधारण तापमान पर, बोरान बहुत निष्क्रिय है। उच्च तापमान पर, यह सक्रिय हो जाता है, ऑक्सीजन, हैलोजेन, सल्फर, नाइट्रोजन, कार्बन, हाइड्रोजन और कई धातुओं के साथ बातचीत करता है।
बोरान धीरे-धीरे फ्लोरीन, गर्म केंद्रित नाइट्रिक एसिड और एक्वा रेजिया जैसे मजबूत ऑक्सीकरण एजेंटों के साथ प्रतिक्रिया करता है। अनाकार बोरान केंद्रित क्षार में उबलने पर धीरे-धीरे घुल जाता है:
2B + 2NOH + 2H 2 O \u003d 2NaBO 2 + 3H 2
बोरान के लिए लैटिमर आरेख:
1- -1,822
बोरोन ट्राईऑक्साइड बी 2 ओ 3 एक एसिड ऑक्साइड है। इसके तीन हाइड्रेटेड रूपों को जाना जाता है - बोरिक एसिड एच 3 बीओ 3 - ऑर्थोबोरिक एसिड
एचबीओ 2 - मेटाबोलिक एसिड
एच 2 बी 4 ओ 7 - टेट्राबोरिक एसिड
रूसी संघ की शिक्षा और विज्ञान की मंत्रालय
उच्च व्यावसायिक शिक्षा का राज्य शैक्षिक संस्थान
रूसी राज्य विश्वविद्यालय
ओआईएल और जीएएस का नाम आई.एम. Gubkin
RSU OIL और GAS के नाम पर I.M. Gubkin
ऑरेनबर्ग में
अनुशासन में परीक्षा "रसायन विज्ञान"
मैं जाँच की:
"__" ____________ 2011
द्वारा निर्मित:
छात्र जीआर
"__" ____________ 2011
1 हाइड्रोक्लोरिक, नाइट्रिक, सल्फ्यूरिक और फॉस्फोरिक एसिड 3 के साथ लोहे और सोने की बातचीत
२ कार्य ५
सन्दर्भ ६
1 हाइड्रोक्लोरिक, नाइट्रिक, सल्फ्यूरिक और फॉस्फोरिक एसिड के साथ लोहे और सोने का समावेश
हाइड्रोजन (H 2) तक की गतिविधि के क्रम में धातु किसी भी एकाग्रता और केंद्रित सल्फ्यूरिक एसिड (H 2 SO 4) के नाइट्रिक एसिड (HNO 3 को छोड़कर) के एसिड घोल से इसे विस्थापित करती है, यदि गठित नमक घुलनशील हो।
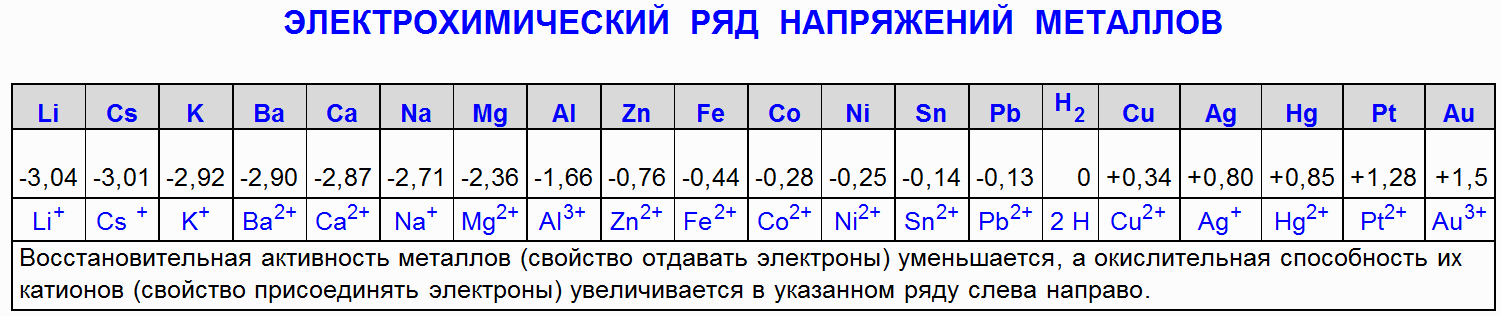
1.1 हाइड्रोक्लोरिक एसिड (HCl) के साथ लोहे (Fe) की सहभागिता
आयरन क्लोराइड (FeCl 2) और हाइड्रोजन (H 2) उत्पन्न करने के लिए आयरन (Fe) केंद्रित और तनु हाइड्रोक्लोरिक एसिड (HCl) के साथ प्रतिक्रिया करता है:
Fe + 2HCl → FeCl 2 + H 2
1.2 नाइट्रिक एसिड (HNO 3) के साथ लोहे (Fe) की सहभागिता
आयरन (Fe) को केंद्रित नाइट्रिक एसिड के साथ निष्क्रिय किया जाता है, अर्थात एक पतली सतह का यौगिक बनता है जो क्षरण को रोकता है।
Fe + 4HNO 3 (25%) → Fe (NO 3) 3 + NO + 2H 2 O
आयरन (Fe) पतला नाइट्रिक एसिड के साथ सहभागिता करता है, और एसिड की सांद्रता के आधार पर, न केवल विभिन्न नाइट्रोजन कटौती उत्पादों का निर्माण होता है, बल्कि विभिन्न लौह ऑक्सीकरण उत्पाद भी होते हैं:
4Fe + 10HNO 3 (2%) → Fe (NO 3) 2 + NH 4 NO 3 + 3H 2 O
1.3 सल्फ्यूरिक एसिड (एच 2 एसओ 4) के साथ लोहे (Fe) की बातचीत
लोहे (III) सल्फेट के गठन के साथ केंद्रित सल्फ्यूरिक एसिड के साथ लोहे (Fe) की प्रतिक्रिया:
2Fe + 6H 2 SO 4 (70%) → Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
आयरन (II) लवण बनाने के लिए सल्फ्यूरिक एसिड के साथ आयरन प्रतिक्रिया करता है:
Fe + H 2 SO 4 (20%) → FeSO 4 + H 2
1.4 फॉस्फोरिक एसिड (एच 3 पीओ 4) के साथ लोहे (Fe) की बातचीत
फॉस्फोरिक एसिड बहुत धीरे-धीरे लोहे के साथ प्रतिक्रिया करता है, इसका कारण यह है कि हाइड्रोजन परमाणुओं की संख्या में यह ट्राइसासिक एसिड है।
फॉस्फोरिक एसिड का उपयोग जंग (लोहे के आक्साइड) से लोहे की सफाई में किया जाता है। फॉस्फोरिक एसिड, धातु की सतह से अपने ऑक्साइड को हटाकर, लोहे के साथ बहुत धीरे-धीरे प्रतिक्रिया करता है। आयरन ऑक्साइड को FePO 4 के घुलनशील नमक में परिवर्तित किया जाता है, जिसे एसिड अवशेषों के साथ पानी से धोया जाता है।
2H 3 PO 4 + Fe 2 O 3 → 2FePO 4 + 3H 2 O
1.5 हाइड्रोक्लोरिक (एचसीएल), नाइट्रिक (एचएनओ 3), सल्फ्यूरिक (एच 2 एसओ 4) और फॉस्फोरिक (एच 3 पीओ 4) एसिड के साथ सोने (एयू) की बातचीत
सोना सबसे अक्रिय धातु है, अन्य सभी धातुओं के दाईं ओर तनाव की श्रृंखला में खड़ा है, सामान्य परिस्थितियों में यह अधिकांश एसिड के साथ बातचीत नहीं करता है और ऑक्साइड नहीं बनाता है, जिसके कारण इसे साधारण धातुओं के विपरीत वर्गीकृत किया गया था, जो पर्यावरण के प्रभाव में आसानी से नष्ट हो जाता है।
औ + ह 2 एसओ 4 →
औ + ह 3 पीओ 4 →
2 कार्य
२.१ ४ (पृष्ठ ९)
16 ग्राम / मोल
उत्तर: उह मुझे \u003d 108 ग्राम / मोल और ई एस \u003d 16 ग्राम / मोल
२.२ ३१ (पृष्ठ ३२)
2.3 नं। 57 (पृष्ठ 57)
वी गैस \u003d 22.4 l / mol ∙ 0.045 mol \u003d 1 l
उत्तर है:वी गैसों \u003d 1 एल
संदर्भों की सूची
Glinka N. L. "सामान्य रसायन विज्ञान में कार्य और अभ्यास।" विश्वविद्यालयों / एड के लिए पाठ्यपुस्तक। वी। ए। राबिनोविच और एच। एम। रुबीना - 22 वें संस्करण।, स्टीरियोटाइपेड। 1984. - 264s।, बीमार।
विश्वविद्यालयों / एड के लिए ग्लिंका एन। एल। "जनरल केमिस्ट्री" पाठ्यपुस्तक। वी। ए। राबिनोविच - 20 वां संस्करण।, स्टीरियोटाइप्ड। 1987.– 889 पीपी।, बीमार
लेबेडेवा एम। आई।, अंकुडीमोवा आई। ए। "विशिष्ट और जटिल समस्याओं के समाधान के साथ रसायन विज्ञान में समस्याओं और अभ्यासों का एक संग्रह: एक कार्यशाला" मॉस्को: "मैशिनोस्ट्रोनी -1" पब्लिशिंग हाउस, 2002. 166 पी।
http://ru.wikipedia.org/
http://convertr.ru
लोहा - रासायनिक तत्व
1. रासायनिक तत्वों की आवधिक तालिका में लोहे की स्थिति और इसके परमाणु की संरचना
आयरन समूह VIII का घ-तत्व है; क्रम संख्या - 26; परमाणु द्रव्यमानअर (Fe) ) \u003d 56; परमाणु संरचना: 26 प्रोटॉन; 30 - न्यूट्रॉन; 26 - इलेक्ट्रॉन।
परमाणु की संरचना:
इलेक्ट्रॉनिक फॉर्मूला: 1s 2 2s 2 2p 6 3s 2 3p 6 3D 6 4s 2
मध्यम गतिविधि धातु, कम करने वाले एजेंट:
Fe 0 -2 e - → Fe +2 कम करने वाला एजेंट ऑक्सीकरण होता है
Fe 0 -3 e - → Fe +3 कम करने वाला एजेंट ऑक्सीकरण होता है
मुख्य ऑक्सीकरण बताता है: +2, +3
2. लोहे का प्रचलन
लोहा प्रकृति में सबसे आम तत्वों में से एक है। । पृथ्वी की पपड़ी में, इसका द्रव्यमान अंश 5.1% है; इस सूचक के अनुसार, यह केवल ऑक्सीजन, सिलिकॉन और एल्यूमीनियम के लिए दूसरा। आकाशीय पिंडों में बहुत सारा लोहा भी पाया जाता है, जिसे वर्णक्रमीय विश्लेषण के अनुसार स्थापित किया जाता है। गैर-ऑक्सीकृत राज्य में लोहे के नमूने लूना स्वचालित स्टेशन द्वारा वितरित चंद्र मिट्टी के नमूनों में पाए गए थे।
पृथ्वी पर लोहे के अयस्क काफी व्यापक हैं। उरल में पहाड़ों के नाम खुद के लिए बोलते हैं: उच्च, चुंबकीय, लोहा। मिट्टी में एग्रोकेमिस्ट लोहे के यौगिक पाते हैं।
लोहा अधिकांश चट्टानों का हिस्सा है। लोहा प्राप्त करने के लिए, 30-70% या अधिक लोहे की सामग्री के साथ लोहे के लोहे का उपयोग किया जाता है।
मुख्य लोहे के अयस्क हैं :
मैग्नेटाइट (चुंबकीय लौह अयस्क) - फे 3 ओ 4 72% लोहा होता है, दक्षिण Urals में जमा होता है, कुर्स्क चुंबकीय विसंगति:
|
|
|
हेमटिट (लोहे की चमक, खून) - फे २ ओ ३65% तक लोहा होता है, इस तरह के जमा Krivorozhsky जिले में पाए जाते हैं:
|
|
|
लिमोनाईट (भूरा लौह अयस्क) - फे 2 ओ 3 * एनएच 2 ओ 60% तक लोहा होता है; क्रीमिया में जमा होते हैं:

पाइराइट (सल्फर पाइराइट, आयरन पाइराइट, बिल्ली का सोना) - FeS 2 इसमें लगभग 47% लोहा शामिल है, मूत्रालय में जमा पाया जाता है।

3. मानव जीवन और पौधों में लोहे की भूमिका
बायोकेमिस्ट्स ने पौधों, जानवरों और मनुष्यों के जीवन में लोहे की महत्वपूर्ण भूमिका की खोज की है। हीमोग्लोबिन नामक एक अत्यंत जटिल कार्बनिक यौगिक का हिस्सा होने के नाते, लोहा इस पदार्थ के लाल रंग को निर्धारित करता है, जो बदले में मनुष्यों और जानवरों के रक्त का रंग निर्धारित करता है। एक वयस्क के शरीर में 3 ग्राम शुद्ध लोहा होता है, जिसका 75% हीमोग्लोबिन का हिस्सा होता है। हीमोग्लोबिन की मुख्य भूमिका फेफड़ों से ऊतकों तक ऑक्सीजन का स्थानांतरण है, और विपरीत दिशा में, सीओ 2।
पौधों के लिए भी लोहा आवश्यक है। यह साइटोप्लाज्म का हिस्सा है, प्रकाश संश्लेषण की प्रक्रिया में शामिल है। लोहे से मुक्त सब्सट्रेट पर उगने वाले पौधों में सफेद पत्तियां होती हैं। सब्सट्रेट को लोहे का एक छोटा सा जोड़ - और वे हरे रंग में बदल जाते हैं। इसके अलावा, यह लोहे से युक्त नमक के समाधान के साथ एक सफेद चादर को कम करने के लायक है, और जल्द ही घटी हुई जगह हरी हो जाती है।
तो एक और एक ही कारण से - रस और ऊतकों में लोहे की उपस्थिति - पौधों की पत्तियां धीरे-धीरे हरे हो जाती हैं और एक व्यक्ति के गाल उज्ज्वल रूप से लाल हो जाते हैं।
4. लोहे के भौतिक गुण।
लोहा एक चांदी-सफेद धातु है जिसका गलनांक 1539 ° C होता है। यह बहुत ही नमनीय होता है, इसलिए यह आसानी से संसाधित, जालीदार, लुढ़का हुआ, मोहरदार होता है। लोहे में चुम्बकित और विघटित करने की क्षमता होती है, इसलिए इसका उपयोग विभिन्न विद्युत मशीनों और उपकरणों में विद्युत चुम्बक के कोर के रूप में किया जाता है। थर्मल और मैकेनिकल तरीकों से इसे अधिक ताकत और कठोरता दी जा सकती है, उदाहरण के लिए, शमन और रोलिंग द्वारा।
रासायनिक रूप से शुद्ध और तकनीकी रूप से शुद्ध लोहा हैं। तकनीकी रूप से शुद्ध लोहा, वास्तव में, कम कार्बन स्टील है, इसमें 0.02-0.04% कार्बन होता है, और ऑक्सीजन, सल्फर, नाइट्रोजन और फास्फोरस और भी कम होते हैं। रासायनिक रूप से शुद्ध लोहे में 0.01% से कम अशुद्धियाँ होती हैं। रासायनिक रूप से शुद्ध लोहा -चांदी ग्रे, चमकदार, प्लैटिनम धातु के समान दिखने में। रासायनिक रूप से शुद्ध लोहा जंग के लिए प्रतिरोधी है और एसिड के लिए अच्छी तरह से प्रतिरोधी है। हालांकि, अशुद्धियों का एक नगण्य अंश उसे इन बहुमूल्य गुणों से वंचित करता है।
5. लोहे का उत्पादन
कार्बन या कार्बन मोनोऑक्साइड (II), और साथ ही हाइड्रोजन के आक्साइड से कमी:
फेओ + सी \u003d फे + सीओ
Fe 2 O 3 + 3CO \u003d 2Fe + 3CO 2
फे 2 ओ 3 + 3 एच 2 \u003d 2 एफ + 3 एच 2 ओ
अनुभव "aluminothermy द्वारा लौह उत्पादन"
6. लोहे के रासायनिक गुण
उपसमूह के एक तत्व के रूप में, लोहे ऑक्सीकरण के कई डिग्री का प्रदर्शन कर सकता है। हम केवल उन यौगिकों पर विचार करेंगे जिनमें लोहा +2 और +3 के ऑक्सीकरण राज्यों को प्रदर्शित करता है। इस प्रकार, हम यह कह सकते हैं कि लोहे में यौगिकों की दो पंक्तियाँ होती हैं, जिसमें यह द्विगुणित और त्रिगुट होता है।
1) हवा में, नमी (जंग) की उपस्थिति में लोहे को आसानी से ऑक्सीकृत किया जाता है:
4Fe + 3O 2 + 6H 2 O \u003d 4Fe (OH) 3
2) एक लाल गर्म लोहे का तार ऑक्सीजन में जलता है, जिससे एक स्केल बनता है - आयरन ऑक्साइड (II, III) - एक काला पदार्थ:
3 एफ + 2 ओ 2 \u003d फे 3 ओ 4
सीनम हवा में ऑक्सीजन बनता है फे 2 हे 3 * राष्ट्रीय राजमार्ग 2 हे
अनुभव "ऑक्सीजन के साथ लोहे की बातचीत"
3) उच्च तापमान (700-900 ° C) पर, जल वाष्प के साथ लोहा प्रतिक्रिया करता है:
3Fe + 4H 2 O t˚C → Fe 3 O 4 + 4H 2
4) लोहा गैर-धातुओं के साथ गर्म होने पर प्रतिक्रिया करता है:
Fe + S t˚C → FeS
5) लोहा हाइड्रोक्लोरिक में आसानी से घुलनशील है और सामान्य परिस्थितियों में सल्फ्यूरिक एसिड को पतला करता है:
Fe + 2HCl \u003d FeCl 2 + H 2
Fe + H 2 SO 4 (विघटित) \u003d FeSO 4 + H 2
6) संकेंद्रित अम्लों में - ऑक्सीकरण एजेंट, लोहा गर्म होने पर ही घुलते हैं
2 एफ + 6 एच 2 एसओ 4 (संक्षिप्त ।) t 3C → Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Fe + 6HNO 3 (संक्षिप्त ।) t +C → Fe (NO 3) 3 + 3NO 2 + 3H 2 Oआयरन (III)
7. लोहे का उपयोग।
दुनिया के लोहे के थोक का उपयोग कच्चा लोहा और इस्पात बनाने के लिए किया जाता है - कार्बन और अन्य धातुओं के साथ लोहे के मिश्र धातु। कच्चा लोहा में लगभग 4% कार्बन होता है। स्टील में 1.4% से कम कार्बन होता है।
विभिन्न कास्टिंग - भारी मशीनों के बिस्तर, आदि के उत्पादन के लिए कच्चा लोहा आवश्यक है।
कच्चा लोहा उत्पाद
स्टील का उपयोग मशीनरी, विभिन्न निर्माण सामग्री, बीम, चादर, लुढ़का उत्पाद, रेल, उपकरण और कई अन्य उत्पादों के निर्माण के लिए किया जाता है। स्टील के विभिन्न ग्रेडों के उत्पादन के लिए, तथाकथित मिश्रधातु एडिटिव्स का उपयोग किया जाता है, जो विभिन्न धातुएं हैं: एम
व्यायाम मशीन नंबर 2 - आनुवंशिक पंक्ति Fe 3+
सिम्युलेटर नंबर 3 - सरल और जटिल पदार्थों के साथ लोहे की प्रतिक्रियाओं के समीकरण
असाइनमेंट असाइनमेंट
नंबर 1। कम करने वाले एजेंट के रूप में उपयोग करके, इसके आक्साइड Fe 2 O 3 और Fe 3 O 4 से लोहा प्राप्त करने की प्रतिक्रियाओं के लिए समीकरण बनाएं:
ए) हाइड्रोजन;
बी) एल्यूमीनियम;
c) कार्बन मोनोऑक्साइड (II)।
प्रत्येक प्रतिक्रिया के लिए, एक इलेक्ट्रॉनिक संतुलन बनाएं।
नंबर 2। योजना के अनुसार परिवर्तन करें:
Fe 2 O 3 -\u003e Fe - + H2O, t -\u003e X - + CO, t -\u003e Y - + HCl -\u003e Z
उत्पाद X, Y, Z क्या हैं?
लोहा मध्यम रासायनिक गतिविधि को प्रदर्शित करता है। यह ऑक्सीजन वातावरण में जलता है, जिससे ऑक्साइड Fe 2 O 3 बनता है। एक सूक्ष्म रूप से विभाजित अवस्था में, धातु पायरोफोरिक है, अर्थात। अनायास हवा में प्रज्वलित करने में सक्षम। हाइड्रोजन वायुमंडल में लोहे के ऑक्सालेट के थर्मल अपघटन द्वारा ललित लौह चूर्ण प्राप्त किया जा सकता है।
200 डिग्री सेल्सियस तक के तापमान पर हवा में संग्रहीत होने पर, लोहे को धीरे-धीरे घने ऑक्साइड फिल्म द्वारा कवर किया जाता है, जो धातु के आगे ऑक्सीकरण को रोकता है। नम हवा में, लोहे को जंग की एक ढीली परत के साथ कवर किया जाता है, जो धातु और इसके विनाश के लिए ऑक्सीजन और नमी की पहुंच में हस्तक्षेप नहीं करता है। जंग में एक निरंतर रासायनिक संरचना नहीं होती है, लगभग इसका रासायनिक सूत्र Fe 2 O 3 के रूप में लिखा जा सकता है।
आयरन सल्फाइड के साथ प्रतिक्रिया करता है सल्फाइड बनाने के लिए, सक्रिय रूप से क्लोरीन, ब्रोमीन और आयोडीन के साथ ट्राइक्लोराइड, ट्राइब्रोमाइड और डायोडाइड के गठन के साथ सक्रिय रूप से संपर्क करता है। सतह पर घने, कम-वाष्पशील ट्राइफ्लोराइड फिल्म के गठन के कारण फ्लोरीन के साथ आयरन कमजोर रूप से प्रतिक्रिया करता है। 500 डिग्री सेल्सियस से ऊपर के तापमान पर, धातु उल्टा कार्बन के साथ बातचीत करती है:
इस रचना के आयरन कार्बाइड को सीमेंटाइट कहा जाता है। यह कच्चा लोहा और इस्पात में निहित है।
गर्म करने पर आयरन ऑक्सीजन के साथ प्रतिक्रिया करता है। जब लोहे को हवा में जलाया जाता है, तो Fe 2 O 3 ऑक्साइड बनता है; जब इसे शुद्ध ऑक्सीजन में जलाया जाता है, तो Fe 3 O 4 ऑक्साइड बनता है। यदि ऑक्सीजन या हवा को पिघले हुए लोहे से गुजारा जाता है, तो FeO ऑक्साइड बनता है।
गर्म होने पर, नाइट्रोजन नाइट्रोजन के साथ प्रतिक्रिया करता है, लौह नाइट्राइड Fe3N का निर्माण करता है, फॉस्फोरस के साथ, फॉस्फाइड्स FeP, Fe 2 P और Fe 3 P का निर्माण करता है, कार्बन के साथ, सिलिकॉन के साथ कार्बाइड Fe 3 C का निर्माण होता है, उदाहरण के लिए, FeSi कई सिलिकोसिस बनाते हैं। ऊंचा दबाव में, धातु के लोहे कार्बन मोनोऑक्साइड सीओ के साथ प्रतिक्रिया करते हैं, और एक तरल, सामान्य परिस्थितियों में, आसानी से वाष्पशील लोहे पेंटाकारबोनील फे (सीओ) 5 का निर्माण होता है। रचनाओं के आयरन कार्बोनल्स Fe 2 (CO) 9 और Fe 3 (CO) 12 भी ज्ञात हैं। आयरन कार्बोनिल्स फेरोमेनेक रचना सहित ऑर्गोनोमेट्रिक यौगिकों के संश्लेषण में शुरुआती सामग्री के रूप में काम करते हैं।
शुद्ध धात्विक लोहा पानी में और तनु क्षार विलयन में स्थिर होता है। लोहे में केंद्रित सल्फ्यूरिक और नाइट्रिक एसिड नहीं घुलते हैं, क्योंकि एक मजबूत ऑक्साइड फिल्म इसकी सतह को निष्क्रिय कर देती है। लोहा हाइड्रोक्लोरिक और तनु के साथ प्रतिक्रिया करता है (लगभग 20%) सल्फ्यूरिक एसिड से लोहा (II) लवण बनता है:
Fe + 2HCl \u003d FeCl 2 + H 2
Fe + H 2 SO 4 \u003d FeSO 4 + H 2
जब लोहे में लगभग 70% सल्फ्यूरिक एसिड होता है, तो प्रतिक्रिया लोहे के गठन के साथ होती है (III) सल्फेट:
2Fe + 4H 2 SO 4 \u003d Fe 2 (SO 4) 3 + SO 2 + 4H 2 O
वायुमंडलीय नमी और हवा के प्रभाव के तहत, लोहे के तार (जंग):
4Fe + 2H 2 O + 3O 2 \u003d 4FeO (OH)
जंग के कारण, उत्पादित लोहे का 10% तक सालाना खो जाता है।
बहुत शुद्ध लोहा, सल्फर, कार्बन और फास्फोरस की 0.01% से कम अशुद्धियों से युक्त, जंग के लिए प्रतिरोधी है। भारत में दिल्ली शहर के पास एक लोहे का स्तंभ है, जो 9 वीं शताब्दी में स्थापित किया गया था। ईसा पूर्व, जिस पर जंग का कोई निशान नहीं है। यह 99.72% लोहे की सामग्री के साथ बहुत शुद्ध धातु से बना है। प्रसिद्ध स्तंभों की सामग्री के संक्षारण प्रतिरोध में कम से कम भूमिका इस क्षेत्र की जलवायु विशेषताएं नहीं निभा सकती हैं।
गर्म होने पर, धात्विक लोहा क्षारीय पदार्थों के सांद्रण (30% से अधिक) के साथ परस्पर क्रिया करता है, जिससे हाइड्रोक्सोमोप्लेक्स बनते हैं। गर्म होने पर मजबूत ऑक्सीकरण एजेंटों के प्रभाव के तहत, लोहे ऑक्सीकरण राज्य (+ VI) में यौगिकों का निर्माण कर सकते हैं - फेरेट्स:
Fe + 2KNO 3 \u003d K 2 FeO 4 + 2NO
ऑक्सीकरण राज्यों (II) और (III) में ऑक्साइड और हाइड्रॉक्साइड लोहे के लिए जाने जाते हैं।
लोहा लगभग सभी आयनों के साथ सरल लवण बनाता है। पानी के नाइट्रेट, सल्फेट्स, हलाइड्स (फ्लोराइड्स को छोड़कर), एसीटेट आदि घुलनशील हैं। लोहे (II) के कई ऑक्सीकरण एजेंटों द्वारा लोहे को ऑक्सीकरण किया जा सकता है (III) cation। लोहे के लवणों का समाधान (II) और इसके ठोस लवण धीरे-धीरे ऑक्सीकृत होते हैं, यहां तक \u200b\u200bकि हवा में संग्रहीत होने पर भी:
4FeCO 3 + 2H 2 O + O2 \u003d 4FeO (OH) + 2CO 2
4FeS + 6H 2 O + O 2 \u003d 4FeO (OH) + 4H 2 S
सबसे स्थिर ठोस लोहा (II) नमक लोहा (II) -ammonium sulfate hexahydrate (NH4) 2Fe (SO 4) 2.6H 2 O (मोहर का नमक) है।
गर्म होने पर, आयरन सल्फेट, नाइट्रेट, कार्बोनेट और ऑक्सलेट्स सड़ जाते हैं। इस मामले में, लोहे (II) को आमतौर पर लोहे (III) में ऑक्सीकृत किया जाता है, उदाहरण के लिए:
2FeSO 4 \u003d Fe 2 O 3 + SO 3 + SO 2
लोहे का लवण (III) मजबूत हाइड्रोलिसिस से गुजरता है।
लोहा एक प्रसिद्ध रासायनिक तत्व है। यह औसत रासायनिक गतिविधि वाली धातुओं को संदर्भित करता है। लोहे के गुण और अनुप्रयोग हम इस लेख में विचार करेंगे।
प्रकृति में व्यापकता
खनिजों की एक बड़ी संख्या है, जिसमें फेरम शामिल हैं। सबसे पहले, यह मैग्नेटाइट है। यह बहत्तर प्रतिशत लोहा है। इसका रासायनिक सूत्र Fe 3 O 4 है। इस खनिज को चुंबकीय लौह अयस्क भी कहा जाता है। इसमें हल्के भूरे रंग का रंग होता है, कभी-कभी गहरे भूरे रंग के साथ, काले तक, एक धातु की चमक के साथ। सीआईएस देशों के बीच इसका सबसे बड़ा क्षेत्र उरल्स में है।
अगले उच्च लौह खनिज, हेमटिट, सत्तर प्रतिशत इस तत्व से बना है। इसका रासायनिक सूत्र Fe 2 O 3 है। इसे लाल लौह अयस्क भी कहा जाता है। इसका रंग लाल-भूरे से लाल-भूरे रंग तक होता है। CIS देशों का सबसे बड़ा क्षेत्र Krivoy Rog में स्थित है।
तीसरा फेरम खनिज लिमोनाइट है। यहाँ कुल द्रव्यमान का साठ प्रतिशत लोहा है। यह एक क्रिस्टलीय हाइड्रेट है, अर्थात्, पानी के अणुओं को उसके क्रिस्टल जाली में बुना जाता है, इसका रासायनिक सूत्र 2 2 O 3 .H 2 O है। जैसा कि नाम से ही स्पष्ट है, इस खनिज का रंग पीला-भूरा, कभी-कभी भूरा होता है। यह प्राकृतिक गेरू के मुख्य घटकों में से एक है और इसका उपयोग वर्णक के रूप में किया जाता है। इसे भूरा लौह अयस्क भी कहा जाता है। सबसे बड़ी घटना स्थल क्रीमिया और उराल हैं।
साइडराइट में, तथाकथित स्पर लौह अयस्क, अड़तालीस प्रतिशत फेरम। इसका रासायनिक सूत्र FeCO 3 है। इसकी संरचना विषम है और इसमें एक साथ जुड़े विभिन्न रंगों के क्रिस्टल शामिल हैं: ग्रे, पीला हरा, ग्रे-पीला, भूरा-पीला, आदि।
एक उच्च फेरम सामग्री के साथ अंतिम रूप से होने वाला खनिज पाइराइट है। उसके पास ऐसा है रासायनिक सूत्र FeS 2। लोहे में कुल द्रव्यमान का छियालीस प्रतिशत होता है। सल्फर परमाणुओं के लिए धन्यवाद, इस खनिज में एक सुनहरा पीला रंग है।
जांच की गई खनिजों में से कई का उपयोग शुद्ध लोहे के उत्पादन के लिए किया जाता है। इसके अलावा, हेमटिट का उपयोग प्राकृतिक पत्थरों से बने गहनों के निर्माण में किया जाता है। पाइपीस लाजुली के गहनों में पाइराइट समावेश पाया जा सकता है। इसके अलावा, लोहा प्रकृति में जीवित जीवों के हिस्से के रूप में पाया जाता है - यह कोशिका के सबसे महत्वपूर्ण घटकों में से एक है। यह ट्रेस तत्व आवश्यक रूप से पर्याप्त मात्रा में मानव शरीर में प्रवेश करना चाहिए। लोहे के हीलिंग गुण इस तथ्य के कारण हैं कि यह रासायनिक तत्व हीमोग्लोबिन का आधार है। इसलिए, फेरम के उपयोग से रक्त की स्थिति पर अच्छा प्रभाव पड़ता है, और इसलिए, पूरे जीव को एक पूरे के रूप में।
आयरन: भौतिक और रासायनिक गुण
आइए हम इन दो बड़े वर्गों पर विचार करें। लोहा इसकी उपस्थिति, घनत्व, गलनांक आदि है, अर्थात्, पदार्थ की सभी विशिष्ट विशेषताएं जो भौतिकी से जुड़ी हैं। लोहे के रासायनिक गुण अन्य यौगिकों के साथ प्रतिक्रिया करने की इसकी क्षमता है। पहले से शुरू करते हैं।
लोहे के भौतिक गुण
अपने शुद्ध रूप में, सामान्य परिस्थितियों में, यह एक ठोस है। इसमें एक सिल्वर-ग्रे रंग और एक स्पष्ट धातु शीन है। लोहे के यांत्रिक गुणों में एक मोह कठोरता स्तर शामिल है। यह चार (औसत) के बराबर है। लोहे में अच्छी विद्युत और तापीय चालकता होती है। एक ठंडे कमरे में एक लोहे की वस्तु को छूकर अंतिम विशेषता महसूस की जा सकती है। चूंकि यह सामग्री जल्दी से गर्मी का संचालन करती है, इसलिए यह आपकी त्वचा से थोड़े समय में इसका एक बड़ा हिस्सा लेती है, और इसलिए आपको ठंड लगती है।  छूना, उदाहरण के लिए, एक पेड़, यह ध्यान दिया जा सकता है कि इसकी तापीय चालकता बहुत कम है। लोहे के भौतिक गुण इसके पिघलने और क्वथनांक हैं। पहला 1539 डिग्री सेल्सियस, दूसरा 2860 डिग्री सेल्सियस है। यह निष्कर्ष निकाला जा सकता है कि लोहे के विशिष्ट गुण अच्छे लचीलापन और व्यवहार्यता हैं। लेकिन यह सब से बहुत दूर है।
छूना, उदाहरण के लिए, एक पेड़, यह ध्यान दिया जा सकता है कि इसकी तापीय चालकता बहुत कम है। लोहे के भौतिक गुण इसके पिघलने और क्वथनांक हैं। पहला 1539 डिग्री सेल्सियस, दूसरा 2860 डिग्री सेल्सियस है। यह निष्कर्ष निकाला जा सकता है कि लोहे के विशिष्ट गुण अच्छे लचीलापन और व्यवहार्यता हैं। लेकिन यह सब से बहुत दूर है।
में भी भौतिक गुण लोहे में प्रवेश करता है और इसका फेरोमैग्नेटिज़्म है। यह क्या है लोहा, जिसके चुंबकीय गुण हम हर दिन व्यावहारिक उदाहरणों पर देख सकते हैं, एकमात्र धातु है जिसमें इस तरह की विशिष्ट विशिष्टता है। ऐसा इसलिए है क्योंकि यह सामग्री एक चुंबकीय क्षेत्र के प्रभाव में चुंबक करने में सक्षम है। और बाद की समाप्ति पर, लोहे, जिसके चुंबकीय गुणों का गठन किया गया है, लंबे समय तक एक चुंबक रहता है। इस घटना को इस तथ्य से समझाया जा सकता है कि इस धातु की संरचना में कई मुक्त इलेक्ट्रॉन हैं जो स्थानांतरित करने में सक्षम हैं।
रसायन विज्ञान के संदर्भ में
यह तत्व मध्यम गतिविधि की धातुओं को संदर्भित करता है। लेकिन लोहे के रासायनिक गुण अन्य सभी धातुओं (विद्युत रासायनिक श्रृंखला में हाइड्रोजन के दाईं ओर को छोड़कर) के लिए विशिष्ट हैं। यह पदार्थों के कई वर्गों के साथ प्रतिक्रिया करने में सक्षम है।
सरल से शुरू करते हैं
फेरम कार्बन, नाइट्रोजन, हैलोजेन (आयोडीन, ब्रोमीन, क्लोरीन, फ्लोरीन), फॉस्फोरस, कार्बन के साथ सहभागिता करता है। पहली बात पर विचार करना ऑक्सीजन के साथ प्रतिक्रिया है। जब फेरम जलाया जाता है, तो इसके ऑक्साइड बनते हैं। प्रतिक्रिया की स्थिति और दो प्रतिभागियों के बीच के अनुपात के आधार पर, वे विविध हो सकते हैं। इस तरह की बातचीत के एक उदाहरण के रूप में, निम्नलिखित प्रतिक्रिया समीकरण दिए जा सकते हैं: 2Fe + O 2 \u003d 2FeO; 4Fe + 3O 2 \u003d 2Fe 2 O 3; 3 एफ + 2 ओ 2 \u003d फे 3 ओ 4। और आयरन ऑक्साइड (भौतिक और रासायनिक दोनों) के गुण विविध हो सकते हैं, जो इसकी विविधता पर निर्भर करता है। इस तरह की प्रतिक्रिया उच्च तापमान पर होती है।

निम्नलिखित नाइट्रोजन के साथ बातचीत है। यह भी गर्म होने पर ही हो सकता है। अगर हम छह मोल आयरन और एक मोल नाइट्रोजन लेते हैं, तो हमें दो मोल आयरन नाइट्राइड मिलता है। प्रतिक्रिया समीकरण निम्नानुसार दिखेगा: 6 एफ + एन 2 \u003d 2 एफ 3 एन।
फास्फोरस के साथ बातचीत करते समय, फॉस्फाइड का गठन होता है। निम्नलिखित घटक प्रतिक्रिया को पूरा करने के लिए आवश्यक हैं: फेरम के तीन मोल के लिए, फॉस्फोरस का एक मोल, परिणामस्वरूप फॉस्फाइड का एक मोल बनता है। समीकरण इस प्रकार लिखा जा सकता है: 3Fe + P \u003d Fe 3 P।
इसके अलावा, सरल पदार्थों के साथ प्रतिक्रियाओं के बीच, सल्फर के साथ बातचीत को भी प्रतिष्ठित किया जा सकता है। इस मामले में, सल्फाइड प्राप्त किया जा सकता है। वह सिद्धांत जिसके द्वारा इस पदार्थ के निर्माण की प्रक्रिया होती है, ऊपर वर्णित के समान है। अर्थात्, इसके अतिरिक्त प्रतिक्रिया होती है। इस तरह के सभी रासायनिक इंटरैक्शन के लिए, विशेष परिस्थितियों की आवश्यकता होती है, मुख्य रूप से उच्च तापमान, कम अक्सर उत्प्रेरक।
रासायनिक उद्योग में लोहे और हैलोजन के बीच प्रतिक्रियाएं भी आम हैं। ये क्लोरीनेशन, ब्रोमिनेशन, आयोडिनेशन, फ्लूरिनेशन हैं। जैसा कि स्वयं प्रतिक्रियाओं के नाम से स्पष्ट है, यह क्लोराइड / ब्रोमीन / फ्लोरीन परमाणुओं के क्रमशः क्लोराइड / ब्रोमाइड / आयोडाइड / फ्लुइडाइड के गठन के साथ फेरोम परमाणुओं के लगाव की प्रक्रिया है। इन पदार्थों का व्यापक रूप से विभिन्न उद्योगों में उपयोग किया जाता है। इसके अलावा, फेरम उच्च तापमान पर सिलिकॉन के साथ संयोजन करने में सक्षम है। कारण तथ्य यह है कि रासायनिक गुण लोहा विविध है, इसका उपयोग अक्सर रासायनिक उद्योग में किया जाता है।
फेरम और जटिल पदार्थ
से सरल पदार्थ आइए उन पर चलते हैं जिनके अणुओं में दो या अधिक विभिन्न रासायनिक तत्व होते हैं। पहली बात यह है कि पानी के साथ फेरम की प्रतिक्रिया है। यहाँ लोहे के मूल गुण प्रकट होते हैं। जब पानी को गर्म किया जाता है, तो यह लोहे के साथ मिलकर बनता है (ऐसा इसलिए कहा जाता है, क्योंकि जब उसी पानी से प्रतिक्रिया की जाती है, तो यह हाइड्रोक्साइड बनाता है, दूसरे शब्दों में, आधार)। इसलिए, यदि आप दोनों घटकों में से एक मोल लेते हैं, तो पदार्थ एक फफूंद डाइऑक्साइड और हाइड्रोजन के रूप में एक तीखी गंध वाली गैस के रूप में बनते हैं - एक से एक दाढ़ अनुपात में भी। इस तरह की प्रतिक्रिया का एक समीकरण इस प्रकार लिखा जा सकता है: Fe + H 2 O \u003d FeO + H 2। जिन अनुपातों के आधार पर इन दोनों घटकों को मिलाना है, उनके आधार पर लोहा या ट्राइऑक्साइड लेना संभव है। ये दोनों पदार्थ रासायनिक उद्योग में बहुत आम हैं, और कई अन्य उद्योगों में भी उपयोग किए जाते हैं।
एसिड और लवण के साथ
चूंकि फेरम धातु गतिविधि के विद्युत रासायनिक श्रृंखला में हाइड्रोजन के बाईं ओर स्थित है, इसलिए यह इस तत्व को यौगिकों से विस्थापित करने में सक्षम है। इसका एक उदाहरण प्रतिस्थापन प्रतिक्रिया है, जो एसिड में लोहे को जोड़ने पर मनाया जा सकता है। उदाहरण के लिए, यदि आप एक ही दाढ़ अनुपात में मध्यम सांद्रता में लोहा और सल्फेट एसिड (यह सल्फ्यूरिक है) मिलाते हैं, तो इसके परिणामस्वरूप हमें एक ही दाढ़ के अनुपात में लौह सल्फेट (II) और हाइड्रोजन मिलता है। इस तरह की प्रतिक्रिया का समीकरण इस तरह दिखेगा: Fe + H 2 SO 4 \u003d FeSO 4 + H 2।
लवण के साथ बातचीत करते समय, लोहे के कम करने वाले गुण प्रकट होते हैं। यही है, इसके साथ आप नमक से कम सक्रिय धातु का चयन कर सकते हैं। उदाहरण के लिए, यदि आप एक मोल और समान मात्रा में फेरम लेते हैं, तो आप एक ही दाढ़ अनुपात में लौह सल्फेट (II) और शुद्ध तांबा प्राप्त कर सकते हैं।
शरीर के लिए मूल्य
पृथ्वी की पपड़ी में सबसे आम रासायनिक तत्वों में से एक लोहा है। हमने पहले ही विचार कर लिया है, अब हम इसे जैविक दृष्टिकोण से देखेंगे। फेरम सेलुलर स्तर पर और पूरे जीव के स्तर पर बहुत महत्वपूर्ण कार्य करता है। सबसे पहले, लोहे हीमोग्लोबिन जैसे प्रोटीन का आधार है। यह फेफड़ों से रक्त के माध्यम से ऑक्सीजन के परिवहन के लिए आवश्यक है, शरीर के प्रत्येक कोशिका, अंगों, मुख्य रूप से मस्तिष्क के न्यूरॉन्स के लिए। इसलिये उपयोगी गुण लोहे को कम करके नहीं आंका जा सकता।

इस तथ्य के अलावा कि यह रक्त निर्माण को प्रभावित करता है, थाइराइड थायरॉयड ग्रंथि के पूर्ण कामकाज के लिए भी महत्वपूर्ण है (यह केवल आयोडीन की आवश्यकता नहीं है, जैसा कि कुछ लोग सोचते हैं)। इसके अलावा, लोहा इंट्रासेल्युलर चयापचय में भाग लेता है, प्रतिरक्षा को नियंत्रित करता है। यहां तक \u200b\u200bकि फेरम में यकृत कोशिकाओं में विशेष रूप से बड़ी मात्रा में पाया जाता है, क्योंकि यह हानिकारक पदार्थों को बेअसर करने में मदद करता है। यह हमारे शरीर में कई प्रकार के एंजाइमों के मुख्य घटकों में से एक है। एक व्यक्ति के दैनिक आहार में दस से बीस मिलीग्राम तक इस रोगाणु का समावेश होना चाहिए।
आयरन युक्त खाद्य पदार्थ
उनमें से कई हैं। वे दोनों पौधे और पशु मूल के हैं। पहले अनाज, फलियां, अनाज (विशेष रूप से एक प्रकार का अनाज), सेब, मशरूम (सफेद), सूखे फल, गुलाब कूल्हों, नाशपाती, आड़ू, avocados, कद्दू, बादाम, खजूर, टमाटर, ब्रोकोली, गोभी, ब्लूबेरी, ब्लैकबेरी, अजवाइन, आदि हैं। दूसरा जिगर, मांस है। गर्भावस्था के दौरान लोहे में उच्च खाद्य पदार्थों का उपयोग विशेष रूप से महत्वपूर्ण है, क्योंकि गठन करने वाले शरीर को पूर्ण विकास और विकास के लिए इस रोगाणु की एक बड़ी मात्रा की आवश्यकता होती है।
शरीर में लोहे की कमी के लक्षण
शरीर में प्रवेश करने वाले बहुत कम फेरम के लक्षणों में थकावट, हाथों और पैरों का लगातार जमना, अवसाद, भंगुर बाल और नाखून, बौद्धिक गतिविधि में कमी, पाचन खराब होना, खराब प्रदर्शन और थायराइड की समस्याएं शामिल हैं। यदि आप इन लक्षणों में से कई को नोटिस करते हैं, तो आपको अपने आहार में लोहे के साथ खाद्य पदार्थों की संख्या में वृद्धि करनी चाहिए या फेरम युक्त विटामिन या पोषण संबंधी खुराक खरीदना चाहिए। आपको डॉक्टर से भी सलाह लेनी चाहिए अगर आपको भी इनमें से कोई भी लक्षण महसूस होता है। 
उद्योग में फेरम का उपयोग
लोहे के उपयोग और गुणों का निकट संबंध है। इसकी फेरोमैग्नेटिज़्म के कारण, इसका उपयोग मैग्नेट के निर्माण के लिए किया जाता है - दोनों घरेलू उद्देश्यों के लिए कमजोर (स्मारिका फ्रिज मैग्नेट, आदि) और औद्योगिक उद्देश्यों के लिए मजबूत होते हैं। इस तथ्य के कारण कि प्रश्न में धातु में उच्च शक्ति और कठोरता है, इसका उपयोग प्राचीन काल से हथियारों, कवच और अन्य सैन्य और घरेलू उपकरणों के निर्माण के लिए किया गया है। वैसे, प्राचीन मिस्र में भी, उल्कापिंड का लोहा जाना जाता था, जिनके गुण साधारण धातु से बेहतर होते हैं। इसके अलावा, प्राचीन रोम में ऐसे विशेष लोहे का उपयोग किया जाता था। इससे संभ्रांत हथियार बनाए गए थे। उल्का धातु से बनी एक ढाल या तलवार केवल एक बहुत अमीर और महान व्यक्ति के पास हो सकती थी।

सामान्य तौर पर, इस लेख में हम जिस धातु पर विचार करते हैं, वह इस समूह में सभी पदार्थों के बीच सबसे अधिक बहुमुखी है। सबसे पहले, स्टील और कच्चा लोहा इससे बनाया जाता है, जो उद्योग और रोजमर्रा की जिंदगी में आवश्यक सभी प्रकार के उत्पादों के उत्पादन के लिए उपयोग किया जाता है।
कच्चा लोहा लोहे और कार्बन का एक मिश्र धातु है, जिसमें दूसरा 1.7 से 4.5 प्रतिशत तक मौजूद है। यदि दूसरा 1.7 प्रतिशत से कम है, तो इस तरह के मिश्र धातु को स्टील कहा जाता है। यदि रचना में लगभग 0.02 प्रतिशत कार्बन है, तो यह एक साधारण तकनीकी लोहा है। मिश्रधातु में कार्बन की मौजूदगी इसे अधिक मजबूती, ऊष्मा प्रतिरोध, और जंग का प्रतिरोध देने के लिए आवश्यक है।
इसके अलावा, स्टील में अशुद्धियों के रूप में कई अन्य रासायनिक तत्व शामिल हो सकते हैं। यह मैंगनीज, और फास्फोरस, और सिलिकॉन है। इसके अलावा, क्रोमियम, निकल, मोलिब्डेनम, टंगस्टन और कई अन्य रासायनिक तत्वों को इस तरह के मिश्र धातु में जोड़ा जा सकता है ताकि इसे कुछ गुण मिल सकें। स्टील के प्रकार जिनमें बड़ी मात्रा में सिलिकॉन मौजूद होता है (लगभग चार प्रतिशत) का उपयोग ट्रांसफार्मर के रूप में किया जाता है। वे, जिनमें बहुत सारे मैंगनीज (बारह से चौदह प्रतिशत तक) होते हैं, वे रेलवे, मिलों, क्रशर और अन्य साधनों के निर्माण में अपना आवेदन पाते हैं, जिनमें से कुछ हिस्सों में तेजी से घर्षण होता है।
मोलिब्डेनम को और अधिक गर्मी प्रतिरोधी बनाने के लिए मिश्र धातु में पेश किया जाता है - ऐसे स्टील्स का उपयोग टूल स्टील्स के रूप में किया जाता है। इसके अलावा, चाकू और अन्य घरेलू उपकरणों के रूप में स्टेनलेस स्टील को ज्ञात और अक्सर रोजमर्रा की जिंदगी में इस्तेमाल करने के लिए, मिश्र धातु में क्रोमियम, निकल और टाइटेनियम को जोड़ना आवश्यक है। और प्रभाव प्रतिरोधी, उच्च शक्ति, नमनीय स्टील प्राप्त करने के लिए, बस इसमें वैनेडियम मिलाएं। जब निओबियम को संरचना में पेश किया जाता है, तो संक्षारण और रासायनिक रूप से आक्रामक पदार्थों के लिए उच्च प्रतिरोध प्राप्त किया जा सकता है।
खनिज मैग्नेटाइट, जिसका उल्लेख लेख की शुरुआत में किया गया था, हार्ड ड्राइव, मेमोरी कार्ड और इस प्रकार के अन्य उपकरणों के निर्माण के लिए आवश्यक है। इसके चुंबकीय गुणों के कारण, लोहा ट्रांसफार्मर, मोटर्स, इलेक्ट्रॉनिक उत्पादों आदि में पाया जा सकता है। इसके अलावा, फेरम को अन्य धातुओं के मिश्र धातुओं में जोड़ा जा सकता है ताकि उन्हें अधिक ताकत और यांत्रिक स्थिरता मिल सके। इस तत्व की सल्फेट का उपयोग बागवानी में कीटों को नियंत्रित करने के लिए किया जाता है (तांबे सल्फेट के साथ)।  पानी का उपचार करते समय अपूरणीय हैं। इसके अलावा, मैग्नेटाइट पाउडर का उपयोग काले और सफेद प्रिंटर में किया जाता है। पाइराइट का उपयोग करने की मुख्य विधि इसमें से सल्फ्यूरिक एसिड प्राप्त करना है। यह प्रक्रिया तीन चरणों में प्रयोगशाला की परिस्थितियों में होती है। पहले चरण में, फेरम का पाइराइट जलाया जाता है, जिससे लौह ऑक्साइड और सल्फर डाइऑक्साइड प्राप्त होता है। दूसरे चरण में, सल्फर डाइऑक्साइड का अपने ट्राइऑक्साइड में रूपांतरण ऑक्सीजन की भागीदारी के साथ होता है। और अंतिम चरण में, परिणामस्वरूप पदार्थ उत्प्रेरक की उपस्थिति से गुजरता है, जिससे सल्फ्यूरिक एसिड प्राप्त होता है।
पानी का उपचार करते समय अपूरणीय हैं। इसके अलावा, मैग्नेटाइट पाउडर का उपयोग काले और सफेद प्रिंटर में किया जाता है। पाइराइट का उपयोग करने की मुख्य विधि इसमें से सल्फ्यूरिक एसिड प्राप्त करना है। यह प्रक्रिया तीन चरणों में प्रयोगशाला की परिस्थितियों में होती है। पहले चरण में, फेरम का पाइराइट जलाया जाता है, जिससे लौह ऑक्साइड और सल्फर डाइऑक्साइड प्राप्त होता है। दूसरे चरण में, सल्फर डाइऑक्साइड का अपने ट्राइऑक्साइड में रूपांतरण ऑक्सीजन की भागीदारी के साथ होता है। और अंतिम चरण में, परिणामस्वरूप पदार्थ उत्प्रेरक की उपस्थिति से गुजरता है, जिससे सल्फ्यूरिक एसिड प्राप्त होता है।
लोहे का उत्पादन
इस धातु को मुख्य रूप से इसके दो मुख्य खनिजों से प्राप्त किया जाता है: मैग्नेटाइट और हेमेटाइट। वे कोक के रूप में कार्बन के साथ इसके यौगिकों से लोहे को कम करके ऐसा करते हैं। यह ब्लास्ट फर्नेस में किया जाता है, जिसका तापमान दो हजार डिग्री सेल्सियस तक पहुंच जाता है। इसके अलावा, हाइड्रोजन के साथ फेरम को बहाल करने का एक तरीका है। इसके लिए, एक ब्लास्ट फर्नेस आवश्यक नहीं है। इस विधि को लागू करने के लिए, वे विशेष मिट्टी लेते हैं, इसे कुचल अयस्क के साथ मिलाते हैं और इसे शाफ्ट भट्टी में हाइड्रोजन के साथ संसाधित करते हैं।
निष्कर्ष
लोहे के गुण और उपयोग विविध हैं। यह शायद हमारे जीवन में सबसे महत्वपूर्ण धातु है। मानव जाति के लिए ज्ञात होने के बाद, उन्होंने कांस्य की जगह ली, जो उस समय सभी उपकरणों के निर्माण के लिए मुख्य सामग्री थी, साथ ही साथ हथियार भी थे। स्टील और कास्ट आयरन कई तरह से तांबे के मिश्र धातु से बेहतर होते हैं जो टिन के साथ उनके भौतिक गुणों और यांत्रिक तनाव के प्रतिरोध के मामले में बेहतर होते हैं।
इसके अलावा, हमारे ग्रह पर लोहा कई अन्य धातुओं की तुलना में अधिक सामान्य है। यह पृथ्वी की पपड़ी में लगभग पांच प्रतिशत है। यह प्रकृति में चौथा सबसे प्रचुर रासायनिक तत्व है। साथ ही, यह रासायनिक तत्व जानवरों और पौधों के जीवों के सामान्य कामकाज के लिए बहुत महत्वपूर्ण है, क्योंकि मुख्य रूप से हीमोग्लोबिन इसके आधार पर बनाया गया है। आयरन एक आवश्यक ट्रेस तत्व है, जिसका उपयोग अंगों के स्वास्थ्य और सामान्य कामकाज को बनाए रखने के लिए महत्वपूर्ण है। उपरोक्त के अलावा, यह एकमात्र धातु है जिसमें अद्वितीय चुंबकीय गुण हैं। फेरम के बिना, हमारे जीवन की कल्पना करना असंभव है।




