Quels composés du fer sont solubles dans l'eau. Propriétés chimiques et physiques du fer
Verser 5-6 gouttes d'acides dans quatre tubes à essai: solution de HCl 2N, solution de H 2 SO 4 2N, H 2 SO 4 concentré, solution nitrique 2N. Dans chaque tube, ajoutez un morceau de copeaux de fer (ou un trombone). Chauffez le tube avec de l'acide sulfurique concentré. Ajoutez ensuite à toutes les solutions une goutte d'une solution 0,01 N de thiocyanate de potassium ou d'ammonium (KCNS ou NH 4 CNS), qui forme le sel de Fe (CNS) 3, qui est intensément coloré en rouge, avec des ions de fer (III). Dans quels acides se forment les ions Fe 3+?
Dans les acides où la solution ne s'est pas tachée de rouge, des ions Fe 2+ se forment lors de la dissolution du fer.
Ajouter et égaliser les réactions de dissolution du fer dans différents acides et indiquer dans chacun d'eux l'agent oxydant:
a) Fe + HCl ® H 2 + ........
b) Fe + H 2 SO 4 (décomp.) ® H 2 + ........
c) Fe + H 2 SO 4 (conc) ® SO 2 + H 2 O + ........
d) Fe + HNO 3 (décomp.) ® NO + H 2 O + .......
Expérience 2. Obtention d'hydroxyde de fer (II) et étude de ses propriétés.
Les sels de fer (II) dus à l'oxydation partielle dans l'air contiennent toujours des ions fer (III). Par conséquent, pour étudier les propriétés du fer (II), il faut prendre le sel cristallin Mora le plus résistant à l'oxydation / (NH 4) 2 SO 4 × Fe (SO 4) × 6H 2 O / et préparer une solution fraîche pour chaque expérience en plaçant plusieurs cristaux en 5 -6 gouttes d'eau.
Verser 2 gouttes de solution de sel de Mohr fraîchement préparée dans trois tubes à essai et ajouter goutte à goutte une solution alcaline 2 N (NaOH) jusqu'à ce qu'un précipité gris verdâtre de Fe (OH) 2 précipite. Dans l'un des tubes contenant le précipité, ajouter une solution d'acide chlorhydrique 2N jusqu'à dissolution. Quelles sont les propriétés (acides ou basiques) de l'hydroxyde de fer (II)? Laisser le culot dans le deuxième tube à l'air pendant plusieurs minutes, en secouant périodiquement le tube. Dans le troisième tube à essai, ajouter 2-3 gouttes d'une solution à 3% de peroxyde d'hydrogène (H 2 O 2). Notez le changement de couleur du précipité du verdâtre au brun dans les deuxième et troisième tubes à essai en raison de la formation d'hydroxyde de fer (III). Quand l'oxydation s'est-elle produite plus rapidement? Écrivez les équations de toutes les réactions: a) obtention d'hydroxyde de fer (II); b) dissoudre le précipité Fe (OH) 2 dans de l'acide chlorhydrique; c) oxydation de Fe (OH) 2 en Fe (OH) 3 avec de l'oxygène atmosphérique avec la participation de l'eau; d) oxydation de Fe (OH) 2 avec du peroxyde d'hydrogène.
Expérience 3. Les propriétés réductrices du fer (II) dans un environnement acide.
Mettre dans un tube à essai 3 gouttes d'une solution de permanganate de potassium (KMnO 4) et 2 gouttes d'une solution 2N d'acide sulfurique. Ajoutez quelques cristaux de sel de Mohr à la solution. Pourquoi le blanchiment se produit-il? Quel est l'agent réducteur dans cette réaction? Ajoutez l'équation de réaction:
KMnO 4 + H 2 SO 4 + FeSO 4 ® MnSO 4 + K 2 SO 4 + H 2 O + .....
Expérience 4. Obtention d'hydroxyde de fer (III) et étude de ses propriétés.
Dans 2 tubes, ajoutez 2 gouttes d'une solution d'un sel de fer (III) (FeCl 3 ou Fe 2 (SO 4) 3) et goutte à goutte une solution de NaOH 2N jusqu'à ce qu'un précipité précipite (marquez la couleur). Verser 5-6 gouttes d'une solution 2N de HCl ou H 2 SO 4 dans un tube, et la même quantité de 2 gouttes d'une solution de NaOH 2N dans un autre. Où les sédiments se sont-ils dissous? Quelles sont les propriétés (basiques ou amphotères) de l'hydroxyde de fer (III)? Écrivez les équations de réaction.
Expérience 5. Propriétés oxydantes du fer (III).
Dans un tube à essai contenant 3 gouttes d'une solution de sel de fer (III), ajoutez 1 à 2 gouttes d'une solution d'iodure de potassium (KI). Notez le changement de couleur de la solution. Quelles sont les propriétés de l'ion Fe 3+? Écrivez l'équation de la réaction, étant donné que l'un des produits de la réaction est I 2.
Expérience 6. L'hydrolyse des sels de fer (II) et de fer (III)
Placer deux bandes de l'indicateur universel sur une lame de verre et appliquer 1 goutte de solutions de sel de Mohr et de chlorure de fer (III) (séparément). Déterminez le pH des solutions de ces sels. Écrivez les équations (ioniques) des réactions d'hydrolyse de ces sels dans la première étape. Quel sel est hydrolysé dans une plus grande mesure? Quel hydroxyde de fer (II) ou de fer (III) a des propriétés plus basiques?
Expérience 7. Réactions qualitatives aux ions fer.
a) Réaction aux ions fer (II)
À 2-3 gouttes d'une solution de sel de Mora, ajoutez 1 goutte d'hexacyanoferrate de potassium (III) (K 3). Marquez la couleur du sédiment KFe. Écrivez l'équation de réaction.
b) Réaction à un ion fer (III)
À 2-3 gouttes d'une solution de chlorure de fer (III), ajoutez 1 goutte d'une solution diluée de thiocyanate de potassium (KCNS) ou d'ammonium (NH 4 CNS). Marquez la couleur de la solution résultante de rhodanure de fer (III). Écrivez l'équation de réaction.
Expérience 8. Obtention d'hydroxydes de cobalt (II), de nickel (II) et étude de leurs propriétés.
a) Pipetter 2-3 gouttes d'une solution de sel de cobalt (CoCl 2) dans deux tubes à essai (marquer la couleur) et ajouter une solution alcaline dans chaque goutte. Tout d'abord, un précipité bleu du sel basique de Co (OH) Cl apparaît, qui change ensuite de couleur en rose en raison de la formation d'hydroxyde de cobalt (II) (Co (OH) 2). Écrivez les équations de réaction pour la formation d'hydroxyde de cobalt (II) par étapes. Agitez le culot dans un tube et laissez-le dans l'air pendant plusieurs minutes. Au précipité dans le deuxième tube à essai, ajouter 2 à 3 gouttes d'une solution de peroxyde d'hydrogène à 3%. Notez le changement de couleur des sédiments. Écrivez les équations pour l'oxydation du Co (OH) 2 en Co (OH) 3 avec l'oxygène atmosphérique et le peroxyde d'hydrogène (H 2 O 2). Quand l'oxydation est-elle plus rapide?
b) Ajouter 2-3 gouttes d'une solution de sel de nickel dans trois tubes à essai (couleur à noter) et ajouter goutte à goutte une solution alcaline jusqu'à ce qu'un précipité d'hydroxyde de nickel (II) précipite (couleur à marquer). Essayez d'oxyder l'hydroxyde résultant avec divers agents oxydants. Pour ce faire, laissez le précipité dans le premier tube à essai dans l'air, ajoutez 2-3 gouttes d'une solution à 3% de Н 2 О 2 dans le deuxième tube à essai et 1 goutte d'eau de brome (Br 2 + H 2 O) dans le troisième tube à essai. Dans quel tube la couleur du précipité est-elle observée, c'est-à-dire est l'oxydation de Ni (OH) 2 en Ni (OH) 3? Pour ajouter les équations de réaction pour la production d'hydroxyde de nickel (II) et d'hydroxyde de nickel (III):
NiSO 4 + NaOH ® Na 2 SO 4 + .....
Ni (OH) 2 + Br 2 + NaOH ® NaBr + H 2 O + ...
Questions de sécurité.
1 .. Écrivez les formules électroniques des atomes de fer, de cobalt, de nickel.
2. Quels degrés d'oxydation sont caractéristiques des atomes d'éléments en fer, cobalt, nickel?
3. Laquelle des substances Fe (OH) 2, Co (OH) 2 ou Ni (OH) 2 est un agent réducteur plus puissant? La conclusion est tirée sur la base des réactions de ces hydroxydes avec l'oxygène atmosphérique, H 2 O 2 et Br 2. (la force de l'agent oxydant augmente dans la série O 2 ® H 2 O 2 ® Br 2).
4. Écrivez les équations de réaction par lesquelles il est possible de distinguer les ions Fe 2+ et Fe 3+.
5. Comment obtenir un sel de fer (II) à partir de fer métallique? Écrivez l'équation de réaction.
6. Comment obtenir le sel de fer (III) du fer métallique? Écrivez l'équation de réaction.
7. Quel sel de fer est le plus hydrolysé: FeCl 2 ou FeCl 3? Écrivez les équations des réactions d'hydrolyse. Quelle est la réaction des solutions de ces sels?
8. Comment convertir le sel de fer (II) en sel de fer (III)? Donnez un exemple d'une telle transition.
9. Comment convertir le sel de fer (III) en sel de fer (II)? Donnez un exemple d'une telle réaction.
10. Peuvent-ils coexister: a) Fe (OH) 2 et H 2 O 2?
b) Ni (OH) 2 et H 2 O 2? Pourquoi? S'il y a une réaction, écrivez-la.
11. Peuvent-ils coexister: a) Ni (OH) 2 et Br 2?
b) FeCl 3 et KI? S'il y a des réactions, écrivez-les.
12. Quel hydroxyde Fe (OH) 2 ou Ni (OH) 2 peut être oxydé par l'oxygène atmosphérique? Si la réaction est en marche, écrivez-la.
13. Sur une surface propre de l'alliage appliqué 1-2 gouttes acide concentré et après 2-3 minutes. du papier filtre humidifié avec une solution de KCNS a été appliqué à la goutte. Une tache rouge est apparue sur le papier. Quel métal est présent dans l'alliage? Écrivez une réaction.
14. Comment obtenir du Co (OH) 3 et du Ni (OH) 3 en laboratoire? Écrivez les équations de réaction.
15. Lorsque le chlore est saturé d'hydroxyde de fer (III) en suspension dans une solution d'hydroxyde de potassium, du ferrate de potassium se forme. Écrivez l'équation de réaction.
16. Écris les équations de réaction: a) entre le ferrate de baryum et le concentré acide chlorhydrique; b) entre le ferrate de potassium et l'iodure de potassium.
17. Que se passe-t-il lorsqu'une solution de carbonate de sodium est ajoutée a) à une solution de sulfate de fer (II); b) à une solution de sulfate de fer (III)? Qu'est-ce qui cause la différence dans la nature des produits formés? Écrivez les équations de réaction.
18. Écrivez les équations de réaction qui peuvent se produire sous l'action d'une solution de sulfure de sodium a) sur une solution de chlorure de fer (II): b) sur une solution de chlorure de fer (III). Le précipité peut-il être dissous dans un excès d'acide chlorhydrique?
19. Quels composés forment le fer, le cobalt, le nickel avec le monoxyde de carbone? Dans quelles conditions les reçoivent-ils?
20. Donnez des exemples de réactions pour la production de ferrites. Que se passe-t-il lorsque l'on ajoute un excès d'eau à la ferrite de sodium Écrivez les équations de réaction.
CHIMIE DES NON-MÉTAUX
Le bore (B) et l'aluminium sont inclus dans le sous-groupe principal du groupe III du système périodique. Il y a trois électrons sur la couche d'électrons externe des atomes:
Puisqu'il n'y a que deux électrons à l'avant-dernier niveau de bore, ses propriétés diffèrent fortement des propriétés des autres éléments du sous-groupe - c'est le seul non-métal du sous-groupe III A. Bien que le bore présente officiellement un état d'oxydation de +3 dans les oxydes et les halogénures, l'ion B +3 est inconnu. Trois nuages \u200b\u200bhybrides sp 2 d'un atome de bore excité sont impliqués dans la formation de liaisons covalentes avec des non-métaux; par conséquent, les composés du bore avec un état d'oxydation de +3 ont une structure triangulaire plate.
Dans les composés contenant des métaux - les borures - le bore est un accepteur d'électrons: Mg 3 B 2, AlB, etc.
Dans des conditions ordinaires, une substance simple est le bore - une substance solide (t PL \u003d 2075 ° C). La structure cristalline du bore est particulière. Il n'est caractéristique ni des métaux ni des non-métaux. Il met en œuvre un plus grand nombre de liaisons (\u003e 4), dont la nature n'est ni typiquement métallique ni covalente ordinaire. Un cristal de bore se compose d'icosaèdres - des twentaèdres réguliers à 12 sommets. Aux températures ordinaires, le bore est très inerte. Aux températures élevées, il devient actif, interagit avec l'oxygène, les halogènes, le soufre, l'azote, le carbone, l'hydrogène et de nombreux métaux.
Le bore réagit lentement avec des agents oxydants puissants tels que le fluor, l'acide nitrique concentré à chaud et l'eau régale. Le bore amorphe se dissout progressivement lors de l'ébullition dans un alcali concentré:
2B + 2NaOH + 2H 2 O \u003d 2NaBO 2 + 3H 2
Diagramme de Latimer pour le bore:
1- -1,822
Le trioxyde de bore B 2 O 3 est un oxyde d'acide. Ses trois formes hydratées sont connues - acides boriques H 3 BO 3 - acide orthoborique
HBO 2 - acide métaborique
H 2 B 4 O 7 - acide tétraborique
MINISTÈRE DE L'ÉDUCATION ET DES SCIENCES DE LA FÉDÉRATION DE RUSSIE
Établissement d'enseignement public de l'enseignement professionnel supérieur
UNIVERSITÉ D'ÉTAT RUSSE
OIL AND GAS nommé d'après I.M. GUBKINA
BRANCHE DE L'HUILE ET DU GAZ RSU nommé d'après I.M. GUBKINA
à Orenburg
Examen dans la discipline "Chimie"
Vérifié:
"__" ____________ 2011
Fabriqué par:
étudiant gr
"__" ____________ 2011
1 Interaction du fer et de l'or avec l'acide chlorhydrique, nitrique, sulfurique et phosphorique 3
2 tâches 5
Références 6
1Interaction du fer et de l'or avec l'acide chlorhydrique, nitrique, sulfurique et phosphorique
Les métaux dans l'ordre d'activité jusqu'à l'hydrogène (H 2) le déplacent d'une solution acide (sauf l'acide nitrique (HNO 3) de toute concentration et l'acide sulfurique concentré (H 2 SO 4)) si le sel formé est soluble.
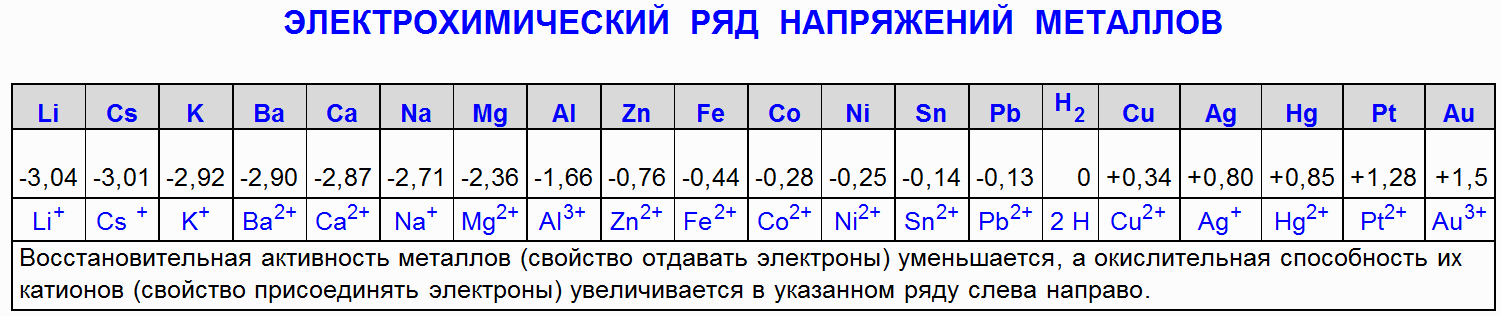
1.1 Interaction du fer (Fe) avec l'acide chlorhydrique (HCl)
Le fer (Fe) réagit avec l'acide chlorhydrique (HCl) concentré et dilué pour former du chlorure de fer (FeCl 2) et de l'hydrogène (H 2):
Fe + 2HCl → FeCl 2 + H 2
1.2 Interaction du fer (Fe) avec l'acide nitrique (HNO 3)
Le fer (Fe) est passivé avec de l'acide nitrique concentré, c'est-à-dire qu'un composé de surface mince est formé qui empêche la corrosion.
Fe + 4HNO 3 (25%) → Fe (NO 3) 3 + NO + 2H 2 O
Le fer (Fe) interagit avec l'acide nitrique dilué, et selon la concentration de l'acide, non seulement divers produits de réduction de l'azote se forment, mais aussi divers produits d'oxydation du fer:
4Fe + 10HNO 3 (2%) → Fe (NO 3) 2 + NH 4 NO 3 + 3H 2 O
1.3 Interaction du fer (Fe) avec l'acide sulfurique (H 2 SO 4)
La réaction du fer (Fe) avec l'acide sulfurique concentré se poursuit avec la formation de sulfate de fer (III):
2Fe + 6H 2 SO 4 (70%) → Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Le fer réagit avec l'acide sulfurique dilué pour former des sels de fer (II):
Fe + H 2 SO 4 (20%) → FeSO 4 + H 2
1.4 Interaction du fer (Fe) avec l'acide phosphorique (H 3 PO 4)
L'acide phosphorique réagit très lentement avec le fer, car il s'agit d'acide tribasique dans le nombre d'atomes d'hydrogène.
L'acide phosphorique est utilisé dans le nettoyage du fer contre la rouille (oxydes de fer). L'acide phosphorique, retirant son oxyde de la surface d'un métal, réagit très lentement avec le fer lui-même. L'oxyde de fer est converti en un sel soluble de FePO 4, qui est lavé avec de l'eau avec des résidus acides.
2H 3 PO 4 + Fe 2 O 3 → 2FePO 4 + 3H 2 O
1.5 Interaction de l'or (Au) avec l'acide chlorhydrique (HCl), nitrique (HNO 3), sulfurique (H 2 SO 4) et phosphorique (H 3 PO 4)
L'or est le métal le plus inerte, se trouvant dans la série de contraintes à droite de tous les autres métaux, dans des conditions normales, il n'interagit pas avec la plupart des acides et ne forme pas d'oxydes, en raison de quoi il a été classé comme un métal noble, contrairement aux métaux ordinaires, facilement détruit sous l'influence de l'environnement.
Au + H 2 SO 4 →
Au + H 3 PO 4 →
2 tâches
2.1 № 4 (p. 9)
16 g / mol
Réponse: Euh Moi \u003d 108 g / mol et E S \u003d 16 g / mol
2.2№ 31 (p. 32)
2.3 n ° 57 (p. 57)
V gaz \u003d 22,4 l / mol ∙ 0,045 mol \u003d 1 l
La réponse est:V gaz \u003d 1 l
Liste de références
Glinka N. L. "Tâches et exercices de chimie générale." manuel pour les universités / éd. V. A. Rabinovich et H. M. Rubina - 22e éd., Stéréotypées. 1984. - 264s., Ill.
Glinka N. L. Manuel de chimie générale pour les universités / éd. V. A. Rabinovich - 20e éd., Stéréotypé. 1987.– 889 pp., Ill.
Lebedeva M. I., Ankudimova I. A. «Une collection de problèmes et d'exercices de chimie avec la solution de problèmes typiques et compliqués: un atelier» Moscou: Maison d'édition «Mashinostroenie-1», 2002. 166 p.
http://ru.wikipedia.org/
http://convertr.ru
Fer - élément chimique
1. La position du fer dans le tableau périodique des éléments chimiques et la structure de son atome
Le fer est un élément d du groupe VIII; numéro de série - 26; masse atomiqueAr (Fe ) \u003d 56; composition atomique: 26 protons; 30 - neutrons; 26 - électrons.
La structure de l'atome:
Formule électronique: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Métal à activité moyenne, agent réducteur:
Fe 0 -2 e - → Fe +2 l'agent réducteur est oxydé
Fe 0-3 e - → Fe +3 l'agent réducteur est oxydé
Les principaux états d'oxydation: +2, +3
2. La prévalence du fer
Le fer est l'un des éléments les plus courants de la nature. . Dans la croûte terrestre, sa fraction massique est de 5,1%; selon cet indicateur, elle juste derrière l'oxygène, le silicium et l'aluminium. On trouve également beaucoup de fer dans les corps célestes, ce qui est établi par analyse spectrale. Des échantillons de fer à l'état non oxydé ont été trouvés dans des échantillons de sol lunaire fournis par la station automatique Luna.
Les minerais de fer sont assez répandus sur Terre. Les noms des montagnes de l'Oural parlent d'eux-mêmes: Haut, Magnétique, Fer. Les agrochimistes du sol trouvent des composés du fer.
Le fer fait partie de la plupart des roches. Pour obtenir du fer, des minerais de fer ayant une teneur en fer de 30 à 70% ou plus sont utilisés.
Les principaux minerais de fer sont :
magnétite (minerai de fer magnétique) - Fe 3 O 4 contient 72% de fer, des gisements se trouvent dans l'Oural du Sud, anomalie magnétique de Koursk:
|
|
|
hématite (éclat de fer, sang) - Fe 2 O 3contient jusqu'à 65% de fer, de tels gisements se trouvent dans le district de Krivorozhsky:
|
|
|
limonite (minerai de fer brun) - Fe 2 O 3 * nH 2 O contient jusqu'à 60% de fer; des dépôts se trouvent en Crimée:

pyrite (pyrite de soufre, pyrite de fer, or de chat) - FeS 2 contient environ 47% de fer; des dépôts se trouvent dans l'Oural.

3. Le rôle du fer dans la vie humaine et les plantes
Les biochimistes ont découvert le rôle important du fer dans la vie des plantes, des animaux et des humains. Faisant partie d'un composé organique extrêmement complexe appelé hémoglobine, le fer détermine la couleur rouge de cette substance, qui à son tour détermine la couleur du sang des humains et des animaux. Le corps d'un adulte contient 3 g de fer pur, dont 75% fait partie de l'hémoglobine. Le rôle principal de l'hémoglobine est le transfert d'oxygène des poumons vers les tissus et, en sens inverse, le CO 2.
Le fer est également nécessaire pour les plantes. Il fait partie du cytoplasme, est impliqué dans le processus de photosynthèse. Les plantes cultivées sur un substrat sans fer ont des feuilles blanches. Un petit ajout de fer au substrat - et ils deviennent verts. De plus, il vaut la peine de graisser une feuille blanche avec une solution de sel contenant du fer, et bientôt l'endroit graissé devient vert.
Donc, pour une seule et même raison - la présence de fer dans les jus et les tissus - les feuilles des plantes deviennent joyeusement vertes et les joues d'une personne rougissent vivement.
4. Propriétés physiques du fer.
Le fer est un métal blanc argenté avec un point de fusion de 1539 ° C. Il est très ductile, il est donc facile à traiter, à forger, à rouler, à emboutir. Le fer a la capacité de magnétiser et de démagnétiser, il est donc utilisé comme noyau d'électro-aimants dans diverses machines et appareils électriques. On peut lui conférer une plus grande résistance et dureté par des méthodes thermiques et mécaniques, par exemple par trempe et laminage.
Il existe du fer chimiquement pur et techniquement pur. Le fer techniquement pur, en fait, est un acier à faible teneur en carbone, il contient 0,02 à 0,04% de carbone, et l'oxygène, le soufre, l'azote et le phosphore sont encore moins. Le fer chimiquement pur contient moins de 0,01% d'impuretés. Fer chimiquement pur -gris argenté, brillant, d'aspect très similaire au métal platine. Le fer chimiquement pur résiste à la corrosion et résiste bien aux acides. Cependant, une fraction négligeable d'impuretés le prive de ces précieuses propriétés.
5. Production de fer
Réduction des oxydes de carbone ou de monoxyde de carbone (II), ainsi que de l'hydrogène:
FeO + C \u003d Fe + CO
Fe 2 O 3 + 3CO \u003d 2Fe + 3CO 2
Fe 2 O 3 + 3H 2 \u003d 2Fe + 3H 2 O
Expérience "Production de fer par aluminothermie"
6. Propriétés chimiques du fer
En tant qu'élément d'un sous-groupe, le fer peut présenter plusieurs degrés d'oxydation. Nous ne considérerons que les composés dans lesquels le fer présente des états d'oxydation de +2 et +3. Ainsi, nous pouvons dire que le fer a deux rangées de composés dans lesquels il est divalent et trivalent.
1) Dans l'air, le fer s'oxyde facilement en présence d'humidité (rouille):
4Fe + 3O 2 + 6H 2 O \u003d 4Fe (OH) 3
2) Un fil de fer chauffé au rouge brûle dans l'oxygène, formant une calamine - oxyde de fer (II, III) - une substance noire:
3Fe + 2O 2 \u003d Fe 3 O 4
Cde l'oxygène dans l'air humide se forme Fe 2 O 3 * nH 2 O
Expérience "Interaction du fer avec l'oxygène"
3) À une température élevée (700–900 ° C), le fer réagit avec la vapeur d'eau:
3Fe + 4H 2 O t˚C → Fe 3 O 4 + 4H 2
4) Le fer réagit avec les non-métaux lorsqu'il est chauffé:
Fe + S t˚C → FeS
5) Le fer est facilement soluble dans les acides sulfuriques chlorhydrique et dilué dans des conditions ordinaires:
Fe + 2HCl \u003d FeCl 2 + H 2
Fe + H 2 SO 4 (décomp.) \u003d FeSO 4 + H 2
6) Dans les acides concentrés - agents oxydants, le fer ne se dissout que lorsqu'il est chauffé
2Fe + 6H 2 SO 4 (conc .) t˚C → Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Fe + 6HNO 3 (conc .) t˚C → Fe (NO 3) 3 + 3NO 2 + 3H 2 OFer (III)
7. L'utilisation du fer.
La majeure partie du fer du monde est utilisée pour produire de la fonte et de l'acier - des alliages de fer avec du carbone et d'autres métaux. La fonte contient environ 4% de carbone. L'acier contient moins de 1,4% de carbone.
La fonte est nécessaire pour la production de diverses pièces moulées - le lit de machines lourdes, etc.
Produits en fonte
L'acier est utilisé pour la fabrication de machines, de divers matériaux de construction, de poutres, de tôles, de produits laminés, de rails, d'outils et de nombreux autres produits. Pour la production de diverses nuances d'acier, les soi-disant additifs d'alliage sont utilisés, qui sont divers métaux: M
Appareil d'entraînement n ° 2 - Ligne génétique Fe 3+
Simulateur n ° 3 - Equations des réactions du fer avec des substances simples et complexes
Affectation Affectations
N ° 1. Faire les équations pour les réactions d'obtention du fer à partir de ses oxydes Fe 2 O 3 et Fe 3 O 4, en utilisant comme agent réducteur:
a) l'hydrogène;
b) aluminium;
c) monoxyde de carbone (II).
Pour chaque réaction, faites une balance électronique.
N ° 2. Effectuer les transformations selon le schéma:
Fe 2 O 3 -\u003e Fe - + H2O, t -\u003e X - + CO, t -\u003e Y - + HCl -\u003e Z
Quels sont les produits X, Y, Z?
Le fer présente une activité chimique modérée. Il brûle dans une atmosphère d'oxygène, formant de l'oxyde Fe 2 O 3. Dans un état finement divisé, le métal est pyrophorique, c'est-à-dire capable de s'enflammer spontanément dans l'air. La poudre de fer fine peut être obtenue par décomposition thermique de l'oxalate de fer dans une atmosphère d'hydrogène.
Lorsqu'il est stocké dans l'air à des températures allant jusqu'à 200 ° C, le fer est progressivement recouvert d'un film d'oxyde dense, ce qui empêche l'oxydation du métal. Dans l'air humide, le fer est recouvert d'une couche de rouille lâche, qui n'interfère pas avec l'accès de l'oxygène et de l'humidité au métal et sa destruction. La rouille n'a pas une composition chimique constante; approximativement sa formule chimique peut être écrite comme Fe 2 O 3.
Le fer réagit avec le soufre fondu pour former du sulfure, interagit activement avec le chlore, le brome et l'iode avec la formation de trichlorure, de tribromure et de diiodure. Le fer réagit faiblement avec le fluor en raison de la formation d'un film de trifluorure dense et peu volatil à la surface. À des températures supérieures à 500 ° C, le métal interagit de façon réversible avec le carbone:
Le carbure de fer de cette composition est appelé cémentite. Il est contenu en fonte et en acier.
Le fer réagit avec l'oxygène lorsqu'il est chauffé. Lorsque le fer est brûlé dans l'air, il se forme de l'oxyde de Fe 2 O 3; lorsqu'il est brûlé dans de l'oxygène pur, de l'oxyde de Fe 3 O 4 se forme. Si de l'oxygène ou de l'air passe à travers du fer fondu, alors de l'oxyde de FeO se forme.
Lorsqu'il est chauffé, le fer réagit avec l'azote, formant du nitrure de fer Fe3N, avec du phosphore, formant des phosphures FeP, Fe 2 P et Fe 3 P, avec du carbone, formant du carbure Fe 3 C, avec du silicium, formant plusieurs siliciures, par exemple FeSi. À une pression élevée, le fer métallique réagit avec le monoxyde de carbone CO, et un liquide, dans des conditions normales, du fer pentacarbonyle Fe (CO) 5 facilement volatil se forme. Les carbonylures de fer des compositions Fe 2 (CO) 9 et Fe 3 (CO) 12 sont également connus. Les carbonyles de fer servent de matières premières dans la synthèse de composés organométalliques, y compris la composition de ferrocène.
Le fer métallique pur est stable dans l'eau et dans les solutions alcalines diluées. Le fer ne se dissout pas dans les acides sulfurique et nitrique concentrés, car un film d'oxyde fort passive sa surface. Le fer réagit avec les acides sulfuriques chlorhydrique et dilué (environ 20%) pour former des sels de fer (II):
Fe + 2HCl \u003d FeCl 2 + H 2
Fe + H 2 SO 4 \u003d FeSO 4 + H 2
Lorsque le fer interagit avec environ 70% d'acide sulfurique, la réaction se poursuit avec la formation de sulfate de fer (III):
2Fe + 4H 2 SO 4 \u003d Fe 2 (SO 4) 3 + SO 2 + 4H 2 O
Sous l'influence de l'humidité atmosphérique et de l'air, le fer se corrode (rouille):
4Fe + 2H 2 O + 3O 2 \u003d 4FeO (OH)
En raison de la corrosion, jusqu'à 10% de tout le fer produit est perdu chaque année.
Le fer très pur, contenant moins de 0,01% d'impuretés de soufre, de carbone et de phosphore, résiste à la corrosion. Près de la ville de Delhi en Inde, il y a une colonne de fer, en retrait au 9ème siècle. BC, sur laquelle il n'y a aucun signe de rouille. Il est fait de métal très pur avec une teneur en fer de 99,72%. Le moindre rôle dans la résistance à la corrosion du matériau des célèbres colonnes peut jouer les caractéristiques climatiques de cette zone.
Lorsqu'il est chauffé, le fer métallique interagit avec des solutions concentrées (plus de 30%) d'alcalis, formant des hydroxocomplexes. Sous l'influence d'agents oxydants puissants, lorsqu'il est chauffé, le fer peut former des composés à l'état d'oxydation (+ VI) - ferrates:
Fe + 2KNO 3 \u003d K 2 FeO 4 + 2NO
Les oxydes et hydroxydes dans les états d'oxydation (II) et (III) sont connus pour le fer.
Le fer forme des sels simples avec presque tous les anions. Les nitrates, sulfates, halogénures (à l'exception des fluorures), acétates, etc. dans l'eau sont solubles. Le cation fer (II) peut être oxydé par de nombreux agents oxydants en cation fer (III). Les solutions de sels de fer (II) et de ses sels solides sont progressivement oxydées même simplement lorsqu'elles sont stockées dans l'air:
4FeCO 3 + 2H 2 O + O2 \u003d 4FeO (OH) + 2CO 2
4FeS + 6H 2 O + O 2 \u003d 4FeO (OH) + 4H 2 S
Le sel de fer solide (II) le plus stable est le sulfate de fer (II) -ammonium hexahydraté (NH4) 2Fe (SO 4) 2.6H 2 O (sel de Mohr).
Lorsqu'ils sont chauffés, les sulfates, nitrates, carbonates et oxalates de fer se décomposent. Dans ce cas, le fer (II) est généralement oxydé en fer (III), par exemple:
2FeSO 4 \u003d Fe 2 O 3 + SO 3 + SO 2
Les sels de fer (III) subissent une forte hydrolyse.
Le fer est un élément chimique bien connu. Il s'agit de métaux ayant une activité chimique moyenne. Les propriétés et l'application du fer que nous examinerons dans cet article.
Prévalence dans la nature
Il existe un assez grand nombre de minéraux, dont le ferrum. Tout d'abord, c'est de la magnétite. C'est soixante-douze pour cent de fer. Sa formule chimique est Fe 3 O 4. Ce minéral est également appelé minerai de fer magnétique. Il a une couleur gris clair, parfois avec un gris foncé, jusqu'au noir, avec un éclat métallique. Son plus grand champ parmi les pays de la CEI se trouve dans l'Oural.
Le prochain minéral riche en fer, l'hématite, est composé à 70% de cet élément. Sa formule chimique est Fe 2 O 3. Il est également appelé minerai de fer rouge. Il a une couleur allant du brun-rouge au gris-rouge. Le plus grand champ des pays de la CEI est situé à Krivoy Rog.
Le troisième minéral ferrum est la limonite. Ici, le fer représente soixante pour cent de la masse totale. Il s'agit d'un hydrate cristallin, c'est-à-dire que des molécules d'eau sont tissées dans son réseau cristallin, sa formule chimique est Fe 2 O 3 .H 2 O. Comme son nom l'indique, ce minéral a une couleur jaunâtre-brunâtre, parfois brune. Il est l'un des principaux composants de l'ocre naturelle et est utilisé comme pigment. Il est également appelé minerai de fer brun. Les sites les plus importants sont la Crimée et l'Oural.
Dans la sidérite, le soi-disant minerai de fer de spar, 48% du ferrum. Sa formule chimique est FeCO 3. Sa structure est hétérogène et se compose de cristaux de différentes couleurs reliés entre eux: gris, vert pâle, gris-jaune, brun-jaune, etc.
Le dernier minéral naturel à haute teneur en ferrum est la pyrite. Il possède de telles formule chimique FeS 2. Le fer contient 46% de la masse totale. Grâce aux atomes de soufre, ce minéral a une couleur jaune doré.
De nombreux minéraux examinés sont utilisés pour produire du fer pur. De plus, l'hématite est utilisée dans la fabrication de bijoux en pierres naturelles. Des inclusions de pyrite peuvent être trouvées dans les bijoux en lapis-lazuli. De plus, le fer se trouve dans la nature en tant qu'élément des organismes vivants - c'est l'un des composants les plus importants de la cellule. Cet oligo-élément doit nécessairement pénétrer dans le corps humain en quantité suffisante. Les propriétés curatives du fer sont en grande partie dues au fait que cet élément chimique est la base de l'hémoglobine. Par conséquent, l'utilisation de ferrum a un bon effet sur l'état du sang et, par conséquent, sur l'ensemble de l'organisme dans son ensemble.
Fer: propriétés physiques et chimiques
Considérons dans l'ordre ces deux grandes sections. Le fer est son apparence, sa densité, son point de fusion, etc. C'est-à-dire toutes les caractéristiques distinctives de la matière associées à la physique. Les propriétés chimiques du fer sont sa capacité à réagir avec d'autres composés. Commençons par le premier.
Propriétés physiques du fer
Dans sa forme pure, dans des conditions normales, c'est un solide. Il a une couleur gris argenté et un éclat métallique prononcé. Les propriétés mécaniques du fer incluent un niveau de dureté Mohs. Il est égal à quatre (moyenne). Le fer a une bonne conductivité électrique et thermique. La dernière caractéristique peut être ressentie en touchant un objet en fer dans une chambre froide. Comme ce matériau conduit rapidement la chaleur, il en prend une grande partie de votre peau en peu de temps, et vous avez donc froid.  En touchant, par exemple, un arbre, on peut noter que sa conductivité thermique est beaucoup plus faible. Les propriétés physiques du fer sont ses points de fusion et d'ébullition. Le premier est de 1539 degrés Celsius, le second est de 2860 degrés Celsius. On peut conclure que les propriétés caractéristiques du fer sont une bonne ductilité et fusibilité. Mais c'est loin d'être tout.
En touchant, par exemple, un arbre, on peut noter que sa conductivité thermique est beaucoup plus faible. Les propriétés physiques du fer sont ses points de fusion et d'ébullition. Le premier est de 1539 degrés Celsius, le second est de 2860 degrés Celsius. On peut conclure que les propriétés caractéristiques du fer sont une bonne ductilité et fusibilité. Mais c'est loin d'être tout.
Aussi dans propriétés physiques le fer entre et son ferromagnétisme. Qu'est ce que c'est Le fer, dont nous pouvons observer quotidiennement les propriétés magnétiques sur des exemples pratiques, est le seul métal présentant une caractéristique unique. En effet, ce matériau est capable de se magnétiser sous l'influence d'un champ magnétique. Et à la fin de ce dernier, le fer, dont les propriétés magnétiques viennent de se former, reste longtemps un aimant. Ce phénomène peut s'expliquer par le fait que dans la structure de ce métal, de nombreux électrons libres sont capables de se déplacer.
En termes de chimie
Cet élément fait référence aux métaux d'activité moyenne. Mais les propriétés chimiques du fer sont typiques de tous les autres métaux (sauf ceux qui se trouvent à droite de l'hydrogène dans la série électrochimique). Il est capable de réagir avec de nombreuses classes de substances.
Commençons par simple
Ferrum interagit avec le carbone, l'azote, les halogènes (iode, brome, chlore, fluor), le phosphore, le carbone. La première chose à considérer est la réaction avec l'oxygène. Lorsque le ferrum est brûlé, ses oxydes se forment. Selon les conditions de réaction et les proportions entre les deux participants, elles peuvent être diverses. Comme exemple de telles interactions, les équations de réaction suivantes peuvent être données: 2Fe + O 2 \u003d 2FeO; 4Fe + 3O 2 \u003d 2Fe 2 O 3; 3Fe + 2O 2 \u003d Fe 3 O 4. Et les propriétés de l'oxyde de fer (physique et chimique) peuvent varier en fonction de sa variété. Ce type de réaction se produit à des températures élevées.

Ce qui suit est l'interaction avec l'azote. Il ne peut également se produire que lorsqu'il est chauffé. Si nous prenons six moles de fer et une mole d'azote, nous obtenons deux moles de nitrure de fer. L'équation de réaction ressemblera à ceci: 6Fe + N 2 \u003d 2Fe 3 N.
Lors de l'interaction avec le phosphore, du phosphure se forme. Les composants suivants sont nécessaires pour effectuer la réaction: pour trois moles de ferrum, une mole de phosphore, en conséquence une mole de phosphure est formée. L'équation peut s'écrire comme suit: 3Fe + P \u003d Fe 3 P.
De plus, parmi les réactions avec des substances simples, l'interaction avec le soufre peut également être distinguée. Dans ce cas, du sulfure peut être obtenu. Le principe par lequel le processus de formation de cette substance se produit est similaire à celui décrit ci-dessus. A savoir, la réaction d'addition se produit. Pour toutes les interactions chimiques de ce type, des conditions particulières sont nécessaires, principalement des températures élevées, moins souvent des catalyseurs.
Les réactions entre le fer et les halogènes sont également courantes dans l'industrie chimique. Ce sont la chloration, la bromation, l'iodation, la fluoration. Comme le montre clairement les noms des réactions elles-mêmes, il s'agit du processus de fixation d'atomes de chlore / brome / iode / fluor aux atomes de ferrum avec formation de chlorure / bromure / iodure / fluorure, respectivement. Ces substances sont largement utilisées dans diverses industries. De plus, le ferrum est capable de se combiner avec du silicium à des températures élevées. En raison du fait que propriétés chimiques le fer est divers, il est souvent utilisé dans l'industrie chimique.
Ferrum et substances complexes
À partir de substances simples Passons à ceux dont les molécules sont constituées de deux ou plusieurs éléments chimiques différents. La première chose à mentionner est la réaction du ferrum avec l'eau. Ici, les propriétés de base du fer se manifestent. Lorsque l'eau est chauffée, elle se forme avec le fer (on l'appelle ainsi car, lorsqu'elle réagit avec la même eau, elle forme de l'hydroxyde, c'est-à-dire la base). Donc, si vous prenez une mole des deux composants, des substances se forment telles que le dioxyde de fer et l'hydrogène sous forme de gaz à l'odeur âcre - également dans des proportions molaires de une à une. Une équation de ce type de réaction peut être écrite comme suit: Fe + H 2 O \u003d FeO + H 2. Selon les proportions dans lesquelles mélanger ces deux composants, il est possible d'obtenir du fer ou du trioxyde. Ces deux substances sont très courantes dans l'industrie chimique et sont également utilisées dans de nombreuses autres industries.
Avec des acides et des sels
Étant donné que le ferrum est situé à gauche de l'hydrogène dans la série électrochimique de l'activité métallique, il est capable de déplacer cet élément des composés. Un exemple de ceci est la réaction de substitution, qui peut être observée lorsque du fer est ajouté à l'acide. Par exemple, si nous mélangeons du fer et de l'acide sulfate (il est sulfurique) de concentration moyenne dans les mêmes proportions molaires, nous obtiendrons du sulfate de fer (II) et de l'hydrogène dans les mêmes proportions molaires. L'équation d'une telle réaction ressemblera à ceci: Fe + H 2 SO 4 \u003d FeSO 4 + H 2.
Lors de l'interaction avec les sels, les propriétés réductrices du fer se manifestent. Autrement dit, avec lui, vous pouvez sélectionner un métal moins actif dans le sel. Par exemple, si vous prenez une mole et la même quantité de ferrum, vous pouvez obtenir du sulfate de fer (II) et du cuivre pur dans les mêmes proportions molaires.
Valeur pour le corps
L'un des éléments chimiques les plus courants de la croûte terrestre est le fer. nous l'avons déjà envisagé, nous allons maintenant l'aborder d'un point de vue biologique. Ferrum remplit des fonctions très importantes à la fois au niveau cellulaire et au niveau de l'organisme entier. Tout d'abord, le fer est à la base d'une protéine telle que l'hémoglobine. Il est nécessaire pour le transport de l'oxygène à travers le sang des poumons à tous les tissus, organes, à chaque cellule du corps, principalement aux neurones du cerveau. Par conséquent propriétés utiles le fer ne peut pas être surestimé.

Outre le fait qu'il affecte la formation de sang, le ferrum est également important pour le bon fonctionnement de la glande thyroïde (cela nécessite non seulement de l'iode, comme certaines personnes le pensent). De plus, le fer participe au métabolisme intracellulaire, régule l'immunité. Même le ferrum se trouve en quantités particulièrement importantes dans les cellules du foie, car il aide à neutraliser les substances nocives. C'est également l'un des principaux composants de nombreux types d'enzymes dans notre corps. Dans le régime alimentaire quotidien d'une personne devrait contenir de dix à vingt milligrammes de ce micro-élément.
Aliments riches en fer
Il y en a beaucoup. Ils sont d'origine végétale et animale. Les premiers sont les céréales, les légumineuses, les céréales (en particulier le sarrasin), les pommes, les champignons (blancs), les fruits secs, les cynorrhodons, les poires, les pêches, les avocats, la citrouille, les amandes, les dattes, les tomates, le brocoli, le chou, les bleuets, les mûres, le céleri, etc. Le second est le foie, la viande. L'utilisation d'aliments riches en fer est particulièrement importante pendant la grossesse, car le corps du fœtus en formation a besoin d'une grande quantité de ce micro-élément pour sa pleine croissance et son développement.
Signes d'un manque de fer dans le corps
Les symptômes d'une trop faible pénétration de ferrum dans le corps comprennent la fatigue, le gel constant des mains et des pieds, la dépression, les cheveux et les ongles cassants, la diminution de l'activité intellectuelle, les troubles digestifs, les mauvaises performances et les problèmes de thyroïde. Si vous remarquez plusieurs de ces symptômes, vous devez augmenter le nombre d'aliments contenant du fer dans votre alimentation ou acheter des vitamines ou des compléments alimentaires contenant du ferrum. Vous devriez également consulter un médecin si vous ressentez l'un de ces symptômes de manière trop aiguë. 
L'utilisation du ferrum dans l'industrie
L'utilisation et les propriétés du fer sont étroitement liées. En raison de son ferromagnétisme, il est utilisé pour la fabrication d'aimants - à la fois plus faibles à des fins domestiques (aimants de réfrigérateur de souvenir, etc.) et plus puissants à des fins industrielles. En raison du fait que le métal en question a une résistance et une dureté élevées, il est utilisé depuis l'Antiquité pour la fabrication d'armes, d'armures et d'autres outils militaires et domestiques. Soit dit en passant, même dans l'Égypte ancienne, le fer de météorite était connu, dont les propriétés étaient supérieures à celles du métal ordinaire. En outre, un tel fer spécial était utilisé dans la Rome antique. Des armes d'élite en ont été fabriquées. Un bouclier ou une épée en métal météorite ne pouvait être obtenu que par un homme très riche et noble.

En général, le métal que nous considérons dans cet article est le plus polyvalent utilisé parmi toutes les substances de ce groupe. Tout d'abord, l'acier et la fonte sont fabriqués à partir de celui-ci, qui sont utilisés pour la production de toutes sortes de produits nécessaires à la fois dans l'industrie et dans la vie quotidienne.
La fonte est un alliage de fer et de carbone, dans lequel le second est présent de 1,7 à 4,5%. Si le second est inférieur à 1,7%, ce type d'alliage est appelé acier. S'il y a environ 0,02 pour cent de carbone dans la composition, alors c'est un fer technique ordinaire. La présence de carbone dans l'alliage est nécessaire pour lui donner une plus grande force, résistance à la chaleur et résistance à la rouille.
De plus, l'acier peut contenir de nombreux autres éléments chimiques comme impuretés. Il s'agit du manganèse, du phosphore et du silicium. De plus, du chrome, du nickel, du molybdène, du tungstène et de nombreux autres éléments chimiques peuvent être ajoutés à ce type d'alliage pour lui conférer certaines qualités. Les types d'acier dans lesquels une grande quantité de silicium est présente (environ quatre pour cent) sont utilisés comme transformateurs. Celles qui contiennent beaucoup de manganèse (jusqu'à douze à quatorze pour cent) trouvent leur application dans la fabrication de pièces de chemins de fer, de broyeurs, de concasseurs et d'autres outils, dont certaines pièces sont sujettes à une abrasion rapide.
Le molybdène est introduit dans l'alliage pour le rendre plus résistant à la chaleur - ces aciers sont utilisés comme aciers à outils. De plus, pour obtenir de l'acier inoxydable connu et souvent utilisé au quotidien sous forme de couteaux et autres outils ménagers, il est nécessaire d'ajouter du chrome, du nickel et du titane à l'alliage. Et pour obtenir de l'acier ductile résistant aux chocs et à haute résistance, ajoutez simplement du vanadium. Lorsque du niobium est introduit dans la composition, une résistance élevée à la corrosion et aux substances chimiquement agressives peut être obtenue.
La magnétite minérale, mentionnée au début de l'article, est nécessaire à la fabrication de disques durs, de cartes mémoire et d'autres appareils de ce type. En raison de ses propriétés magnétiques, le fer peut être trouvé dans les transformateurs, les moteurs, les produits électroniques, etc. De plus, le ferrum peut être ajouté à des alliages d'autres métaux pour leur donner une plus grande résistance et stabilité mécanique. Le sulfate de cet élément est utilisé dans le jardinage pour contrôler les parasites (avec le sulfate de cuivre).  sont irremplaçables lors du traitement de l'eau. De plus, la poudre de magnétite est utilisée dans les imprimantes noir et blanc. La principale méthode d'utilisation de la pyrite consiste à en obtenir de l'acide sulfurique. Ce processus se déroule dans des conditions de laboratoire en trois étapes. Dans la première étape, la pyrite du ferrum est brûlée, obtenant ainsi de l'oxyde de fer et du dioxyde de soufre. Au deuxième stade, la conversion du dioxyde de soufre en son trioxyde se produit avec la participation de l'oxygène. Et au stade final, la substance résultante est passée en présence de catalyseurs, obtenant ainsi de l'acide sulfurique.
sont irremplaçables lors du traitement de l'eau. De plus, la poudre de magnétite est utilisée dans les imprimantes noir et blanc. La principale méthode d'utilisation de la pyrite consiste à en obtenir de l'acide sulfurique. Ce processus se déroule dans des conditions de laboratoire en trois étapes. Dans la première étape, la pyrite du ferrum est brûlée, obtenant ainsi de l'oxyde de fer et du dioxyde de soufre. Au deuxième stade, la conversion du dioxyde de soufre en son trioxyde se produit avec la participation de l'oxygène. Et au stade final, la substance résultante est passée en présence de catalyseurs, obtenant ainsi de l'acide sulfurique.
Production de fer
Ce métal est principalement extrait de ses deux principaux minéraux: la magnétite et l'hématite. Ils le font en réduisant le fer de ses composés avec du carbone sous forme de coke. Cela se fait dans des hauts fourneaux dont la température atteint deux mille degrés Celsius. De plus, il existe un moyen de restaurer le ferrum avec de l'hydrogène. Pour cela, un haut fourneau n'est pas nécessaire. Pour mettre en œuvre cette méthode, ils prennent de l'argile spéciale, la mélangent avec du minerai concassé et la traitent avec de l'hydrogène dans un four à cuve.
Conclusion
Les propriétés et les utilisations du fer sont diverses. C'est peut-être le métal le plus important de nos vies. Devenu connu de l'humanité, il a pris la place du bronze, qui était à l'époque le principal matériau de fabrication de tous les outils, ainsi que des armes. L'acier et la fonte sont à bien des égards supérieurs à l'alliage de cuivre et d'étain en termes de propriétés physiques et de résistance aux contraintes mécaniques.
De plus, le fer sur notre planète est plus courant que de nombreux autres métaux. il dans la croûte terrestre est près de cinq pour cent. Il s'agit du quatrième élément chimique le plus abondant dans la nature. En outre, cet élément chimique est très important pour le fonctionnement normal de l'organisme des animaux et des plantes, principalement parce que l'hémoglobine est construite sur sa base. Le fer est un oligo-élément essentiel, dont l'utilisation est importante pour maintenir la santé et le fonctionnement normal des organes. En plus de ce qui précède, c'est le seul métal qui possède des propriétés magnétiques uniques. Sans ferrum, il est impossible d'imaginer notre vie.




