Неполное окисление сероводорода. Сера. Сероводород. Сульфиды
Сера – это твердое кристаллическое вещество желтого цвета. Температура плавления – 119С о, температура кипения – 444,6С о.
Сера имеет несколько аллотропных модификация. Кристаллическая сера состоит из циклических молекул S 8 имеющих ромбическую форму. Данная модификация является наиболее устойчивой. При кристаллизации серы из расплава получаются игольчатые кристаллы (так называемая моноклинная сера). При температуре примерно 100 С о моноклинная сера переходит в ромбическую (кристаллическую). Если расплавленную серу вылить в холодную воду, образуется пластическая сера. Спустя некоторое время пластическая сера перекристаллизуется и вновь станет жесткой и ломкой.
При температуре 1800 С о пары серы одноатомны. Сера абсолютно нерастворима в воде, немного растворима в этиловом спирте и бензоле, отлично растворима в сероуглероде CS 2 .
Так как атом серы способен проявлять несколько степеней окисления, следовательно, в химических реакциях сера проявляет двойственный, окислительные и восстановительные, свойства. Возможны также реакции диспропорционирования.

Горение серы
С повышением температуры растет химическая активность серы.
- Взаимодействие с кислородом
Сера легко загорается в атмосфере кислорода с образованием оксида серы 2(сернистый газ).
- Взаимодействие с водородом
Если серу расплавить, она легко вступит во взаимодействие с водородом, образуя зловонный газ – сероводород H 2 S.
- Взаимодействие с другими неметаллами
Расплавленная сера реагирует с хлором с образованием хлорида серы 1 (хлористая сера).

Хлорид серы
2S+Cl 2 = S 2 Cl 2
Возможно также получение и других соединений серы с хлором: SCl 2 , SCl 4 .
Хлориды серы разлагаются водой с образованием кислот.

При взаимодействии с металлами сера проявляет окислительные свойства. В данных реакциях образуются сульфиды.
2Al+3S = Al 2 S 3
- Взаимодействие со щелочами
Сера легко вступает в реакции со щелочами
3S+6KOH = K 2 SO 4 +2K 2 S+3H 2 O
Сероводород при нормальных условиях представляет собой бесцветный и очень токсичный газ с характерным запахом тухлых яиц.
Для его получения в лабораторных условиях обычно добавляют разбавленную соляную кислоту к сульфиду :
Другой способ получения сероводорода заключается в добавлении холодной воды к сульфиду алюминия:
Сероводород, полученный таким способом, оказывается чище.
Сероводород - ковалентное соединение. Его молекулы имеют изогнутую структуру, подобную структуре молекул воды (см. разд. 2.2). Однако в отличие от воды молекулы сероводорода не образуют между собой водородных связей. Дело в том, что атом серы менее электроотрицателен, чем атом кислорода, но имеет больший размер. Поэтому атом серы имеет гораздо меньшую плотность заряда, чем атом кислорода. Из-за отсутствия водородных связей сероводород имеет более низкую температуру кипения, чем вода. Отсутствие водородных связей в сероводороде объясняет также его плохую растворимость в воде.
В водном растворе сероводород обладает свойствами слабой двухосновной кислоты:

Сероводород горит в воздухе голубым пламенем. При ограниченном доступе воздуха горение сероводорода сопровождается выделением свободной серы, которая конденсируется на холодной поверхности сосуда:
При избыточном доступе воздуха горение сероводорода приводит к образованию диоксида серы:
Сероводород обладает восстановительными свойствами. Например, он обесцвечивает бромную воду и восстанавливает ионы до ионов
Сероводород как двухосновная кислота может образовывать два ряда солей - сульфиды и гидросульфиды (см. выше). Сульфиды щелочных металлов растворяются в воде с образованием щелочных растворов. Это происходит в результате гидролиза:
Нерастворимые сульфиды других металлов можно осаждать из водных растворов солей этих металлов, пропуская через раствор сероводород. Например, при пропускании сероводорода через раствор, содержащий ионы образуется черный осадок сульфида
Эта реакция используется в качестве аналитической пробы на сероводород.
Оксиды серы
Сера образует несколько оксидов, из которых наибольшее значение имеют два: диоксид серы и триоксид серы
Диоксид серы представляет собой плотный бесцветный газ с резким удушливым запахом. В лабораторных условиях его можно получить, сжигая серу в воздухе или в кислороде, добавляя теплый разбавленный раствор кислоты к какой-нибудь сульфитной соли либо нагревая концентрированную серную кислоту с медью:
Диоксид серы-кислотный оксид. Он легко растворяется в воде, образуя сернистую кислоту. Эта кислота ионизируется лишь частично и, следовательно, представляет собой слабую кислоту:

При пропускании газообразного диоксида серы через раствор гидроксида натрия образуется сульфит натрия . Сульфит натрия, реагируя с избытком диоксида серы, образует гидросульфит натрия Эти реакции аналогичны реакции диоксида углерода с известковой водой.
И газообразный диоксид серы, и его водный раствор являются восстановителями. Например, газообразный диоксид серы восстанавливает оксид с образованием сульфата а сернистая кислота восстанавливает -ион до иона
Диоксид серы в промышленных условиях получают при обжиге на воздухе серы или сульфидных руд и используют как промежуточный продукт в процессе получения серной кислоты (см. гл. 7). Диоксид серы применяется в целлюлозной промышленности, для отбеливания тканей, а также для обработки фруктов и овощей при длительном хранении.
Диоксид серы играет существенную роль в загрязнении атмосферы и особенно в образовании кислотных дождей. В атмосфере он окисляется до триоксида серы:
При нормальных условиях этот процесс протекает достаточно медленно, но в присутствии катализатора он может значительно ускоряться, подобно тому, как это происходит в контактном процессе получения серной кислоты. Небольшие количества соединений железа и марганца, содержащиеся в атмосфере, по-видимому, катализируют окисление диоксида серы. Образующийся триоксид серы реагирует с влагой воздуха, и поэтому появляются облака, которые несут кислотные дожди (см. также гл. 12).
Твердый триоксид серы является полиморфным соединением. Две его важнейшие формы Первая из них представляет собой тример с циклической структурой (рис. 15.24, а); кристаллы прозрачны. имеет ациклическую полимерную структуру (рис. 15.24,б); она существует в виде игольчатых кристаллов. Температура плавления . В присутствии влаги постепенно превращается в Обе формы кипят при 45°С. Пары триоксида серы состоят из изолированных симметричных плоских молекул.

Рис. 15.24. Триоксид серы, а - циклическая структура, б - ациклическая структура.
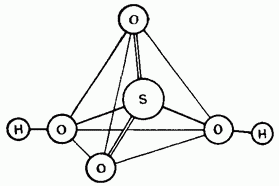
Рис. 15.25. Структура молекулы серной кислоты.
В лабораторных условиях триоксид серы получают нагреванием сульфата
Триоксид серы обладает сильно выраженными кислотными свойствами. Он экзотермически реагирует с водой, образуя серную кислоту:
Триоксид серы - сильный окислитель. Например, он окисляет бромоводород до свободного брома.
Серная кислота
Серная кислота - бесцветная маслянистая едкая жидкость. Это один из важнейших промышленных химических продуктов. Ее промышленное получение с помощью контактного процесса и применения описаны в гл. 7.
Неразбавленная серная кислота представляет собой ковалентное соединение. Ее молекулы имеют тетраэдрическое строение (рис. 15.25).
Серная кислота кипит и разлагается при 340°С, образуя триоксид серы и водяной
Высокая температура кипения и большая вязкость серной кислоты, по-видимому, обусловлены наличием водородных связей между атомами водорода и атомами кислорода соседних молекул.
Серная кислота - сильная двухосновная кислота. В воде она полностью ионизируется, образуя гидросульфат- и сульфат-ионы:
Серная кислота принимает участие во всех реакциях, характерных для кислот. Она реагирует с металлами, образуя сульфаты этих металлов и водород, в реакциях с карбонатами образует сульфаты, диоксид углерода и воду, а в реакциях с основаниями и щелочами образует сульфаты либо гидросульфаты.
Концентрированная серная кислота очень бурно реагирует с водой. По этой причине следует всегда разбавлять серную кислоту, наливая ее в воду, а не наоборот. Эта кислота гигроскопична, т. е. способна поглощать влагу из воздуха. Поэтому ее используют для осушения газов, не реагирующих с нею, пропуская их через серную кислоту. Сродство серной кислоты к воде настолько велико, что серная кислота может служить дегидратирующим агентом; под действием концентрированной серной кислоты:
голубые кристаллы пентагидрата сульфата образуют безводный сульфат
углеводы, например сахароза, обугливаются:
бумага тоже обугливается под действием концентрированной серной кислоты, что обусловлено действием кислоты на целлюлозные волокна;
этанол превращается в этилен:
(дегидратация этанола с помощью серной кислоты, проводимая в контролируемых
условиях, приводит к образованию этоксиэтана (диэтилового эфира) , и эта реакция используется для получения этоксиэтана в промышленных масштабах);
смесь хлоробензола и трихлорэтаналя (хлораля) подвергается дегидратации (см. разд. 16.3).
Концентрированная серная кислота - сильный окислитель. Она окисляет металлы и неметаллы. Например
В качестве других примеров, иллюстрирующих окислительные свойства концентрированной серной кислоты, укажем окисление ионов до ионов , а также бромид-ионов до свободного брома в следующих реакциях:
Наконец, серная кислота используется как сульфирующий агент в органической химии (см. гл. 17).
Сульфаты, сульфиты и тиосоединения
Сульфат-ион имеет тетраэдрическую структуру, подобную структуре молекулы серной кислоты.
Соли. Сульфаты образуются в реакциях разбавленной серной кислоты с металлами, их оксидами, гидроксидами либо карбонатами. За исключением сульфатов бария и остальные сульфаты растворимы в воде. Сульфат кальция обладает небольшой растворимостью в воде. Сульфаты обычно устойчивы к нагреванию. Исключениями в этом отношении являются только сульфаты железа. Например, сульфат при нагревании разлагается с образованием оксида железа:
Для обнаружения сульфат-ионов в каком-либо растворе туда добавляют водный раствор хлорида бария. При наличии в исследуемом растворе сульфат-ионов в результате происходит образование белого осадка сульфата бария:
Сульфаты имеют много важных применений. Например, сульфат магния (английская соль, горькая соль) используется в производстве взрывчатых веществ, для изготовления спичек и огнестойких тканей. Насыщенный раствор этой соли используется в медицинской практике как противовоспалительное средство.
Тиосульфат натрия может рассматриваться как аналог сульфата натрия, в котором один атом кислорода замещен на атом серы. Среди подобных тиосоединений следует упомянуть еще одно - тиоцианат калия . Он представляет собой серный аналог цианата калия . Тиоцианат калия можно получить, сплавляя цианид калия с серой:
Тиоцианат калия используется в качественном анализе для обнаружения ионов Если в исследуемом растворе присутствуют эти ионы, добавление к нему раствора тиоцианата калия приводит к появлению кроваво-красной окраски вследствие образования комплексного иона
Итак, повторим еще раз!
1. При перемещении к нижней части VI группы свойства ее элементов постепенно изменяются от неметаллических к металлическим.
2. Элементы VI группы обладают способностью соединяться с водородом и реакционноспособными металлами, образуя соединения, в которых они имеют степень окисления -2.
3. Кислород обладает высокой электроотрицательностью и свойствами сильного окислителя.
4. Озон является еще более сильным окислителем, чем кислород.
5. Кислород играет чрезвычайно важную роль в биологических системах, участвуя в процессах дыхания и метаболических процессах (обмена веществ).
6. Кислород образует с другими соединениями бинарные соединения, оксиды разнообразных типов:

7. Пероксид водорода является сильным окислителем.
8. Сера в свободном виде может существовать в нескольких энантиотропных формах.
9. Для извлечения серы из подземных залежей применяется процесс Фраша, в котором используется сжатый воздух и перегретый пар.
10. Сера образует соединения, в которых она находится в состояниях со степенями окисления +2, +4, +6 и -2.
11. Сероводород - слабая двухосновная кислота и восстановитель.
12. Газообразный диоксид серы и его водный раствор-восстановители.
13. Триоксид серы имеет сильно выраженные кислотные и окислительные свойства.
14. Серная кислота сильная двухосновная кислота, осушитель, дегидратирующий агент и сильный окислитель.
15. Молекулы серной кислоты и сульфат-ионы имеют тетраэдрическую структуру.
При комнатной температуре сера вступает в реакции только с ртутью. С повышением температуры её активность значительно повышается. При нагревании сера непосредственно реагирует со многими простыми веществами, за исключением инертных газов, азота, селена, теллура, золота, платины, иридия и йода. Сульфиды азота и золота получены косвенным путем.
Взаимодействие с металлами
Сера проявляет окислительные свойства, в результате взаимодействия образуются сульфиды:
Взаимодействие с водородом происходит при 150–200 °С:
H 2 + S = H 2 S.
Взаимодействие с кислородом
Сера горит в кислороде при 280 °С, на воздухе при 360 °С, при этом образуется смесь оксидов:
S + O 2 = SO 2 ;
2S + 3O 2 = 2SO 3 .
Взаимодействие с фосфором и углеродом
При нагревании без доступа воздуха сера реагирует с фосфором, углеродом, проявляя окислительные свойства:
2P + 3S = P 2 S 3 ;
Взаимодействие с фтором
В присутствии сильных окислителей проявляет восстановительные свойства:
S + 3F 2 = SF 6 .
Взаимодействие со сложными веществами
При взаимодействии со сложными веществами сера ведет себя как восстановитель:
S + 2HNO 3 = 2NO + H 2 SO 4 .
Реакция диспропорционирования
Сера способна к реакциям диспропорционирования, при взаимодействии со щелочью образуются сульфиды и сульфиты:
3S + 6KOH = K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O.
1.7. Получение серы
Из самородных руд
При нагревании пирита без доступа воздуха
FeS 2 = FeS + S.
Окислением сероводорода при недостатке кислорода
2H 2 S + O 2 = 2S + 2H 2 O.
Из отходящих газов металлургических и коксовых печей, при нагревании в присутствии катализатора
H 2 S + SO 2 = 2H 2 O + 3S.
1.8. Сероводород
Водородное соединение серы – сероводород H 2 S . Сероводород – ковалентное соединение. Строение молекулы аналогично строению молекулы воды, атом серы находится в состоянии sp 3 -гибридизации, однако в отличие от воды молекулы сероводорода не образуют между собой водородных связей. Атом серы менее электроотрицательный, чем атом кислорода, имеет больший размер и, как следствие, меньшую плотность заряда. Валентный угол HSH составляет 91,1°, длина связи H – S равна 0,133 нм.
Физические свойства
При обычных условиях сероводород – бесцветный газ, с сильным характерным запахом тухлых яиц. Т пл = -86 °С,Т кип = -60 °С, плохо растворим в воде, при 20 °С в 100 г воды растворяется 2,58 мл H 2 S. Очень ядовит, при вдыхании вызывает паралич, что может привести к смертельному исходу. В природе выделяется в составе вулканических газов, образуется при гниении растительных и животных организмов. Хорошо растворим в воде, при растворении образует слабую сероводородную кислоту.
Химические свойства
В водном растворе сероводород обладает свойствами слабой двухосновной кислоты:
H 2 S = HS - + H + ;
HS - = S 2- + H + .
Сероводород горит в воздухе голубым пламенем. При ограниченном доступе воздуха образуется свободная сера:
2H 2 S + O 2 = 2H 2 O + 2S.
При избыточном доступе воздуха горение сероводорода приводит к образованию оксида серы (IV):
2H 2 S + 3O 2 = 2H 2 O + 2SО 2 .
Сероводород обладает восстановительными свойствами. В зависимости от условий сероводород может окисляться в водном растворе до серы, сернистого газа и серной кислоты.
Например, он обесцвечивает бромную воду:
H 2 S + Br 2 = 2HBr + S.
взаимодействует с хлорной водой:
H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8HCl.
Струю сероводорода можно поджечь, используя диоксид свинца, так как реакция сопровождается большим выделением тепла:
3PbO 2 + 4H 2 S = 3PbS + SO 2 + 4H 2 O.
Взаимодействие сероводорода с сернистым газом используется для получения серы из отходящих газов металлургического и сернокислого производства:
SO 2 + 2H 2 S = 3S + 2H 2 O.
С этим процессом связано образование самородной серы при вулканических процессах.
При одновременном пропускании сернистого газа и сероводорода через раствор щелочи образуется тиосульфат:
4SO 2 + 2H 2 S + 6NaOH = 3Na 2 S 2 O 3 + 5H 2 O.
При комнатной температуре сера вступает в реакции только с ртутью. С повышением температуры её активность значительно повышается. При нагревании сера непосредственно реагирует со многими простыми веществами, за исключением инертных газов, азота, селена, теллура, золота, платины, иридия и йода. Сульфиды азота и золота получены косвенным путем.
Взаимодействие с металлами
Сера проявляет окислительные свойства, в результате взаимодействия образуются сульфиды:
Взаимодействие с водородом происходит при 150–200 °С:
H 2 + S = H 2 S.
Взаимодействие с кислородом
Сера горит в кислороде при 280 °С, на воздухе при 360 °С, при этом образуется смесь оксидов:
S + O 2 = SO 2 ;
2S + 3O 2 = 2SO 3 .
Взаимодействие с фосфором и углеродом
При нагревании без доступа воздуха сера реагирует с фосфором, углеродом, проявляя окислительные свойства:
2P + 3S = P 2 S 3 ;
Взаимодействие с фтором
В присутствии сильных окислителей проявляет восстановительные свойства:
S + 3F 2 = SF 6 .
Взаимодействие со сложными веществами
При взаимодействии со сложными веществами сера ведет себя как восстановитель:
S + 2HNO 3 = 2NO + H 2 SO 4 .
Реакция диспропорционирования
Сера способна к реакциям диспропорционирования, при взаимодействии со щелочью образуются сульфиды и сульфиты:
3S + 6KOH = K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O.
1.7. Получение серы
Из самородных руд
При нагревании пирита без доступа воздуха
FeS 2 = FeS + S.
Окислением сероводорода при недостатке кислорода
2H 2 S + O 2 = 2S + 2H 2 O.
Из отходящих газов металлургических и коксовых печей, при нагревании в присутствии катализатора
H 2 S + SO 2 = 2H 2 O + 3S.
1.8. Сероводород
Водородное соединение серы – сероводород H 2 S . Сероводород – ковалентное соединение. Строение молекулы аналогично строению молекулы воды, атом серы находится в состоянии sp 3 -гибридизации, однако в отличие от воды молекулы сероводорода не образуют между собой водородных связей. Атом серы менее электроотрицательный, чем атом кислорода, имеет больший размер и, как следствие, меньшую плотность заряда. Валентный угол HSH составляет 91,1°, длина связи H – S равна 0,133 нм.
Физические свойства
При обычных условиях сероводород – бесцветный газ, с сильным характерным запахом тухлых яиц. Т пл = -86 °С,Т кип = -60 °С, плохо растворим в воде, при 20 °С в 100 г воды растворяется 2,58 мл H 2 S. Очень ядовит, при вдыхании вызывает паралич, что может привести к смертельному исходу. В природе выделяется в составе вулканических газов, образуется при гниении растительных и животных организмов. Хорошо растворим в воде, при растворении образует слабую сероводородную кислоту.
Химические свойства
В водном растворе сероводород обладает свойствами слабой двухосновной кислоты:
H 2 S = HS - + H + ;
HS - = S 2- + H + .
Сероводород горит в воздухе голубым пламенем. При ограниченном доступе воздуха образуется свободная сера:
2H 2 S + O 2 = 2H 2 O + 2S.
При избыточном доступе воздуха горение сероводорода приводит к образованию оксида серы (IV):
2H 2 S + 3O 2 = 2H 2 O + 2SО 2 .
Сероводород обладает восстановительными свойствами. В зависимости от условий сероводород может окисляться в водном растворе до серы, сернистого газа и серной кислоты.
Например, он обесцвечивает бромную воду:
H 2 S + Br 2 = 2HBr + S.
взаимодействует с хлорной водой:
H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8HCl.
Струю сероводорода можно поджечь, используя диоксид свинца, так как реакция сопровождается большим выделением тепла:
3PbO 2 + 4H 2 S = 3PbS + SO 2 + 4H 2 O.
Взаимодействие сероводорода с сернистым газом используется для получения серы из отходящих газов металлургического и сернокислого производства:
SO 2 + 2H 2 S = 3S + 2H 2 O.
С этим процессом связано образование самородной серы при вулканических процессах.
При одновременном пропускании сернистого газа и сероводорода через раствор щелочи образуется тиосульфат:
4SO 2 + 2H 2 S + 6NaOH = 3Na 2 S 2 O 3 + 5H 2 O.
Сера – элемент 3‑го периода и VIA‑группы Периодической системы, порядковый номер 16, относится к халькогенам. Электронная формула атома [ 10 Ne]3s 2 3p 4 , характерные степени окисления 0, ‑II, +IV и +VI, состояние S VI считается устойчивым.
Шкала степеней окисления серы:
Электроотрицательность серы равна 2,60, для нее характерны неметаллические свойства. В водородных и кислородных соединениях находится в составе различных анионов, образует кислородсодержащие кислоты и их соли, бинарные соединения.
В природе – пятнадцатый по химической распространенности элемент (седьмой среди неметаллов). Встречается в свободном (самородном) и связанном виде. Жизненно важный элемент для высших организмов.
Сера S. Простое вещество. Желтая кристаллическая (α‑ромбическая и β‑моноклинная,
при 95,5 °C) или аморфная (пластическая). В узлах кристаллической решетки находятся молекулы S 8 (неплоские циклы типа «корона»), аморфная сера состоит из цепей S n . Низкоплавкое вещество, вязкость жидкости проходит через максимум при 200 °C (разрыв молекул S 8 , переплетение цепей S n). В паре – молекулы S 8 , S 6 , S 4 , S 2 . При 1500 °C появляется одноатомная сера (в химических уравнениях для простоты любая сера изображается как S).
Сера не растворяется в воде и при обычных условиях не реагирует с ней, хорошо растворима в сероуглероде CS 2 .
Сера, особенно порошкообразная, обладает высокой активностью при нагревании. Реагирует как окислитель с металлами и неметаллами:

а как восстановитель – с фтором, кислородом и кислотами (при кипячении):

Сера подвергается дисмутации в растворах щелочей:
3S 0 + 6КОН (конц.) = 2K 2 S ‑II + K 2 S IV O 3 + 3H 2 O
При высокой температуре (400 °C) сера вытесняет иод из иодоводорода:
S + 2НI (г) = I 2 + H 2 S,
но в растворе реакция идет в обратную сторону:
I 2 + H 2 S (p) = 2 HI + S↓
Получение : в промышленности выплавляется из природных залежей самородной серы (с помощью водяного пара), выделяется при десульфурации продуктов газификации угля.
Сера применяется для синтеза сероуглерода, серной кислоты, сернистых (кубовых) красителей, при вулканизации каучука, как средство защиты растений от мучнистой росы, для лечения кожных заболеваний.
Сероводород H 2 S. Бескислородная кислота. Бесцветный газ с удушающим запахом, тяжелее воздуха. Молекула имеет строение дважды незавершенного тетраэдра [::S(H) 2 ]
(sp 3 ‑гибридизация, валетный угол Н – S–Н далек от тетраэдрического). Неустойчив при нагревании выше 400 °C. Малорастворим в воде (2,6 л/1 л Н 2 O при 20 °C), насыщенный раствор децимолярный (0,1М, «сероводородная вода»). Очень слабая кислота в растворе, практически не диссоциирует по второй стадии до ионов S 2‑ (максимальная концентрация S 2‑ равна 1 10 ‑13 моль/л). При стоянии на воздухе раствор мутнеет (ингибитор – сахароза). Нейтрализуется щелочами, не полностью – гидратом аммиака. Сильный восстановитель. Вступает в реакции ионного обмена. Сульфидирующий агент, осаждает из раствора разноокрашенные сульфиды с очень малой растворимостью.
Качественные реакции – осаждение сульфидов, а также неполное сгорание H 2 S с образованием желтого налета серы на внесенном в пламя холодном предмете (фарфоровый шпатель). Побочный продукт очистки нефти, природного и коксового газа.
Применяется в производстве серы, неорганических и органических серосодержащих соединений как аналитический реагент. Чрезвычайно ядовит. Уравнения важнейших реакций:


Получение : в промышленности – прямым синтезом:
Н 2 + S = H 2 S (150–200 °C)
или при нагревании серы с парафином;
в лаборатории – вытеснением из сульфидов сильными кислотами
FeS + 2НCl (конц.) = FeCl 2 + H 2 S
или полным гидролизом бинарных соединений:
Al 2 S 3 + 6Н 2 O = 2Al(ОН) 3 ↓ + 3H 2 S
Сульфид натрия Na 2 S. Бескислородная соль. Белый, очень гигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. При стоянии на воздухе раствор мутнеет (коллоидная сера) и желтеет (окраска полисульфида). Типичный восстановитель. Присоединяет серу. Вступает в реакции ионного обмена.
Качественные реакции на ион S 2‑ – осаждение разноокрашенных сульфидов металлов, из которых MnS, FeS, ZnS разлагаются в НCl (разб.).
Применяется в производстве сернистых красителей и целлюлозы, для удаления волосяного покрова шкур при дублении кож, как реагент в аналитической химии.
Уравнения важнейших реакций:
Na 2 S + 2НCl (разб.) = 2NaCl + H 2 S
Na 2 S + 3H 2 SO 4 (конц.) = SO 2 + S↓ + 2H 2 O + 2NaHSO 4 (до 50 °C)
Na 2 S + 4HNO 3 (конц.) = 2NO + S↓ + 2H 2 O + 2NaNO 3 (60 °C)
Na 2 S + H 2 S (насыщ.) = 2NaHS
Na 2 S (т) + 2O 2 = Na 2 SO 4 (выше 400 °C)
Na 2 S + 4H 2 O 2 (конц.) = Na 2 SO 4 + 4H 2 O
S 2‑ + M 2+ = MnS (телесн.)↓; FeS (черн.)↓; ZnS (бел.)↓
S 2‑ + 2Ag + = Ag 2 S (черн.)↓
S 2‑ + M 2+ = СdS (желт.)↓; PbS, CuS, HgS (черные)↓
3S 2‑ + 2Bi 3+ = Bi 2 S 3 (кор. – черн.)↓
3S 2‑ + 6H 2 O + 2M 3+ = 3H 2 S + 2M(OH) 3 ↓ (M = Al, Cr)
Получение в промышленности – прокаливание минерала мирабилит Na 2 SO 4 10Н 2 O в присутствии восстановителей:
Na 2 SO 4 + 4Н 2 = Na 2 S + 4Н 2 O (500 °C, кат. Fe 2 O 3)
Na 2 SO 4 + 4С (кокс) = Na 2 S + 4СО (800–1000 °C)
Na 2 SO 4 + 4СО = Na 2 S + 4СO 2 (600–700 °C)
Сульфид алюминия Al 2 S 3 . Бескислородная соль. Белый, связь Al – S преимущественно ковалентная. Плавится без разложения под избыточным давлением N 2 , легко возгоняется. Окисляется на воздухе при прокаливании. Полностью гидролизуется водой, не осаждается из раствора. Разлагается сильными кислотами. Применяется как твердый источник чистого сероводорода. Уравнения важнейших реакций:
Al 2 S 3 + 6Н 2 O = 2Al(ОН) 3 ↓ + 3H 2 S (чистый)
Al 2 S 3 + 6НCl (разб.) = 2AlCl 3 + 3H 2 S
Al 2 S 3 + 24HNO 3 (конц.) = Al 2 (SO 4) 3 + 24NO 2 + 12H 2 O (100 °C)
2Al 2 S 3 + 9O 2 (воздух) = 2Al 2 O 3 + 6SO 2 (700–800 °C)
Получение : взаимодействие алюминия с расплавленной серой в отсутствие кислорода и влаги:
2Al + 3S = AL 2 S 3 (150–200 °C)
Сульфид железа (II) FeS. Бескислородная соль. Черно‑серый с зеленым оттенком, тугоплавкий, разлагается при нагревании в вакууме. Во влажном состоянии чувствителен к кислороду воздуха. Нерастворим в воде. Не выпадает в осадок при насыщении растворов солей железа(II) сероводородом. Разлагается кислотами. Применяется как сырье в производстве чугуна, твердый источник сероводорода.
Соединение железа(III) состава Fe 2 S 3 не известно (не получено).
Уравнения важнейших реакций:

Получение:
Fe + S = FeS (600 °C)
Fe 2 O 3 + H 2 + 2H 2 S = 9FeS + 3H 2 O (700‑1000 °C)
FeCl 2 + 2NH 4 HS (изб.) = FeS ↓ + 2NH 4 Cl + H 2 S
Дисульфид железа FeS 2 . Бинарное соединение. Имеет ионное строение Fe 2+ (–S – S–) 2‑ . Темно‑желтый, термически устойчивый, при прокаливании разлагается. Нерастворим в воде, не реагирует с разбавленными кислотами, щелочами. Разлагается кислотами‑окислителями, подвергается обжигу на воздухе. Применяется как сырье в производстве чугуна, серы и серной кислоты, катализатор в органическом синтезе. В природе – рудные минералы пирит и марказит.
Уравнения важнейших реакций:
FeS 2 = FeS + S (выше 1170 °C, вакуум)
2FeS 2 + 14H 2 SO 4 (конц., гор.) = Fe 2 (SO 4) 3 + 15SO 2 + 14Н 2 O
FeS 2 + 18HNO 3 (конц.) = Fe(NO 3) 3 + 2H 2 SO 4 + 15NO 2 + 7H 2 O
4FeS 2 + 11O 2 (воздух) = 8SO 2 + 2Fe 2 O 3 (800 °C, обжиг)
Гидросульфид аммония NH 4 HS. Бескислородная кислая соль. Белый, плавится под избыточным давлением. Весьма летучий, термически неустойчивый. На воздухе окисляется. Хорошо растворим в воде, гидролизуется по катиону и аниону (преобладает), создает щелочную среду. Раствор желтеет на воздухе. Разлагается кислотами, в насыщенном растворе присоединяет серу. Щелочами не нейтрализуется, средняя соль (NH 4) 2 S не существует в растворе (условия получения средней соли см. в рубрике «H 2 S»). Применяется в качестве компонента фотопроявителей, как аналитический реагент (осадитель сульфидов).
Уравнения важнейших реакций:
NH 4 HS = NH 3 + H 2 S (выше 20 °C)
NH 4 HS + НCl (разб.) = NH 4 Cl + H 2 S
NH 4 HS + 3HNO 3 (конц.) = S↓ + 2NO 2 + NH 4 NO 3 + 2H 2 O
2NH 4 HS (насыщ. H 2 S) + 2CuSO 4 = (NH 4) 2 SO 4 + H 2 SO 4 + 2CuS↓
Получение : насыщение концентрированного раствора NH 3 сероводородом:
NH 3 Н 2 O (конц.) + H 2 S (г) = NH 4 HS + Н 2 O
В аналитической химии раствор, содержащий равные количества NH 4 HS и NH 3 Н 2 O, условно считают раствором (NH 4) 2 S и используют формулу средней соли в записи уравнений реакций, хотя сульфид аммония полностью гидролизуется в воде до NH 4 HS и NH 3 Н 2 O.

