Серная кислота катализатор. Тема: Производство серной кислоты контактным способом
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ ТАДЖИКИСТАН
ТАДЖИКСКИЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ им.акад.ОСИМИ
ФАКУЛЬТЕТ «ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ И МЕТАЛЛУРГИЯ»
КАФЕДРА «Химическая технология неорганических материалов»
Курсовая работа
по дисциплине «ОСНОВЫ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ»
Производство серной кислоты контактным способом
Выполнил:
Студент 3 курса
дневного отделения
группы 480103-02
Малышев Дмитрий
Руководитель проекта: к.х.н., доцент Гайбуллаева З.Х.
Душанбе-2011
1.1 Введение
2 Используемое сырье и его классификация
3 Выбор технологической схемы и ее обоснование
3.2 Функциональная система
3.3 Структурная система
4 Описание технологической схемы
5 Основные физико-химические процессы
6 Автоматизация основных параметров технологической схемы
7 Техника безопасности и охрана труда
8 Заключение
9 Литература
Графическая часть.
1 Технологическая схема производства серной кислоты контактным способом.
1.1 ВВЕДЕНИЕ
Сера была известна в самой глубокой древности. За 1600-2000 лет до нашей эры в Египте применяли ее соединения для отбелки тканей и для получения красок. В древнегреческой поэме Гомера упоминается сера как дезинфекционное средство, римляне применяли ее для фармацевтических целей. Широкое применение серы в промышленности началось в конце 18 века в связи с получением из нее серной кислоты.
Серная кислота впервые бурное развитие получила в связи с производством соды по Леблану (большие количества серной кислоты требовались для получения сульфата натрия из поваренной соли). В 19 веке производства соды и серной кислоты были ведущими и основными отраслями химической промышленности. В связи с возникновением новых отраслей промышленности - искусственных удобрений, взрывчатых веществ, искусственных красителей - потребность в серной кислоте непрерывно увеличивалась и производство ее расширялось.
В настоящее время серная кислота производится двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце 19 и начале 20 века. Контактный способ вытесняет нитрозный (башенный). Первой стадией сернокислотного производства по любому методу является получение диоксида серы при сжигании сернистого сырья. После очистки диоксида серы (особенно в контактном методе) ее окисляют до триоксида серы, который соединяют с водой с получением серной кислоты. Окисление SO2 в SO3 в обычных условиях протекает крайне медленно. Для ускорения процесса применяют катализаторы. В настоящее время контактным методом получают концентрированную серную кислоту, олеум и 100% серный ангидрид.
Ни одна отрасль промышленности практически не может обойтись без серной кислоты. Особенно широко серная кислота применяется в химической промышленности, поэтому ее часто называют «хлебом» химии».
Основным потребителем серной кислоты в странах СНГ является производство минеральных удобрений. На него расходуется свыше 40% всей вырабатываемой серной кислоты. Для получения 1 тонны суперфосфата, например, расходуется около 350 кг, а 1 тонны сульфата аммония - около 750 кг серной кислоты. В связи с тем, что производство минеральных удобрений постоянно растет, естественно, потребуется дальнейшее увеличение производства серной кислоты.
Значительное количество серной кислоты используется в производстве искусственного волокна, органических промежуточных продуктов и красителей, дымообразующих и взрывчатых веществ. Она применяется в нефтяной, металлургической металлообрабатывающей, текстильной, кожевенной и других отраслях промышленности. Серную кислоту часто используют в качестве осушивающего и водоотнимающего средства.
Развитие производства серной кислоты в настоящее время идет по линии строительства мощных систем, интенсификации технологии процесса и аппаратуры, использования для получения серной кислоты серы, содержащейся в отходах различных производств. Большое внимание уделяется расширению ассортимента продукции сернокислотных заводов и повышению ее качества.
Одна из важнейших задач - автоматическое регулирование процесса производства серной кислоты, что в большой мере определяет технический уровень производства.
В 1970-е годы в СССР начали внедрять автоматизированные системы управления (АСУ). Это системы информационно-диспетчерского типа. В настоящее время проектируются системы, в которых управление всеми механизмами, пуск и остановка систем производится несколькими операторами из центрального пункта управления.
Для производства серной кислоты используется довольно широкий ассортимент сырья. Так, наряду с серным колчеданом применяют серу, отходящие серосодержащие газы цветной металлургии, сероводород, гипс, фосфогипс, отработанную серную кислоту и другие. Из всех этих видов сырья все возрастающее значение имеет сера.
Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Объясняется это и тем, что она самая дешевая из всех кислот, а также ее свойствами. Серная кислота не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из самых сильных кислот, в широком диапазоне температур (от -40…-20 до 260-336,5ºС) находится в жидком состоянии.
Серная кислота может существовать как самостоятельное химическое соединение H2SO4, а также в виде соединений с водой H2SO4·2H2O, H2SO4·H2O, H2SO4·4H2O и с триоксидом серы H2SO4·SO3 , H2SO4·2SO3. В технике серной кислотой называют и безводную H2SO4 и ее водные растворы (по сути дела, это смесь H2O, H2SO4 и соединений H2SO4·nH2O), и растворы триоксида серы в безводной H2SO4 - олеум (смесь H2SO4 и соединений H2SO4·nSO3). Безводная серная кислота - тяжелая маслянистая бесцветная жидкость, смешивающаяся с водой и триоксидом серы в любом соотношении. Физические свойства серной кислоты, такие, как плотность, температура кристаллизации, температура кипения, зависят от ее состава. Безводная 100%-ная серная кислота имеет сравнительно высокую температуру кристаллизации 10,7ºC. Чтобы уменьшить возможность замерзания товарного продукта при перевозке и хранении, концентрацию технической серной кислоты выбирают такой, чтобы она имела достаточно низкую температуру кристаллизации. Промышленность выпускает три вида товарной серной кислоты (башенная кислота, контактная кислота и олеум).
Области применения серной кислоты чрезвычайно обширны (рис.1). Рис.1. Применение серной кислоты.
1.2 ИСПОЛЬЗУЕМОЕ СЫРЬЕ И ЕГО КЛАССИФИКАЦИЯ
Сырьем в производстве серной кислоты могут быть элементарная сера и различные серосодержащие соединения, из которых может быть получена сера или непосредственно оксид серы (IV). Природные залежи самородной серы невелики. Чаще всего сера находится в природе в форме сульфидов металлов и сульфатов металлов, а также входит в состав нефти, каменного угля, природного и попутного газов. Значительные количества серы содержатся в виде оксида серы в топочных газах и газах цветной металлургии и в виде сероводорода, выделяющегося при очистке горючих газов. Таким образом, сырьевые источники производства серной кислоты достаточно многообразны, хотя до сих пор в качестве сырья используют преимущественно элементарную серу и железный колчедан. Ограниченное использование таких видов сырья, как топочные газы тепловых электростанций и газы медеплавильного производства, объясняется низкой концентрацией в них оксида серы (IV). Для получения серной кислоты используют серу или содержащие серу соединения, из которых может быть получен сернистый ангидрид. Один из распространенных видов сырья для получения серной кислоты - пирит, или серный колчедан FeS2. Встречается соединение серы с двумя металлами, например с медью и железом (халькопирит). Сера есть в угле, нефти, горючих и топочных газах. Много серы в виде сернистого ангидрида имеется в составе отходящих газов металлургических печей. Сера содержится и в сероводороде, получающемся при коксовании угля или содержащемся в генераторном газе, газах нефтепереработки, попутных нефтяных газах и природном газе. Иногда для производства серной кислоты используют отходы некоторых производств, применяющих серную кислоту. Это кислые гудроны, травильные растворы, фосфогипс и др. А. Рядовой серный колчедан В большинстве стран основным сырьем для производства серной кислоты до сих пор служит пирит. В химически чистом пирите, FeS2, как это легко высчитать из формулы, содержит 53,46% серы и 46,54% железа. В природном колчедане содержится серы - 25-52%, а железа - 35-44%. Основные примеси колчедана следующие: сернистые соединения меди, цинка, свинца, мышьяка, никеля, кобальта, селена, теллура, углекислые и сернокислые соли кальция, магния и др.; тальк, кварц и часто в незначительных количествах золото и серебро. Мышьяк присутствует, главным образом, в виде FeAsS (мышьяковый колчедан), медь в виде FeCuS (медный колчедан), Cu2S (медный блеск) и CuS (коввелин). Серный колчедан FeS2, существует в двух кристаллических модификациях: 1)пирит - кристаллизуется в правильные системы, имеет желтоватый и зеленовато-серый цвет;
2)марказит - встречается гораздо реже, чем пирит.
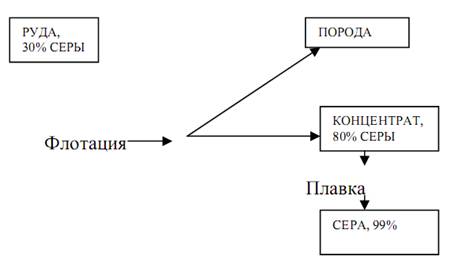
Существуют следующие сорта колчедана: рядовой, флотационный и пиритный концентрат. Рядовой колчедан - добывают в рудниках в виде кусков размером 50-400 мм. Флотационный колчедан - получается как отход при флотационном обогащении руд, содержащихся в качестве примесей к рядовому колчедану. Пиритный концентрат получают при вторичной флотации колчедана с отделением пустой породы. Флотационный метод обогащения основан на различной смачиваемости зерен отдельных минералов водой. Частицы несмачиваемого (гидрофобного) минерала, не преодолевая сил поверхностного натяжения воды, остаются на поверхности. Частицы смачиваемого (гидрофильного) материала обволакиваются пленкой жидкости и увлекаются на дно аппарата. Минерал, плавающий на поверхности, снимают, отделяя от руды. Флотацию проводят во флотационных машинах различного типа. Процесс флотации заключается в смешивании раздробленного колчедана с водой и флотореагентами - пенообразующими веществами (деготь, хвойные масла и др.), и продувании воздуха. Гидрофобные частицы отделяемой примеси колчедана (например, медь) прилипают к воздушным пузырькам и всплывают с ними (это концентрат), а колчедан осаждается на дно (флотационный колчедан, или флотохвосты). Вторичная флотация флотохвостов с применением другого флотореагента дает пиритный концентрат. Пиритный концентрат часто называют также флотационным колчеданом. Перед отправкой потребителю флотационный колчедан высушивают до содержания в нем влаги 3,8%. Флотационный колчедан содержит те же примеси, что и серный колчедан, только в меньших количествах. В качестве сырья для серной кислоты может быть применен также углистый колчедан. Он получается путем отделения от углей (сортировкой и грохочением) и содержит до 18% углерода (именно с этим связано его название). Б) Газы цветной металлургии При обжиге руд цветных металлов (медных, цинковых, свинцовых) или их концентратов образуются газы, содержащие SO2. При получении, например, 1 тонны меди можно получить сернистого ангидрида в количестве, эквивалентном 10 тонн серной кислоты. При этом сырье для серной кислоты получается без затрат на строительство и эксплуатацию печного отделения сернокислотного цеха, отбросные сернистые газы утилизируются, что оздоровляет среду на металлургических заводах и в близлежащих районах. Элементарную серу получают из самородных руд (природных месторождений) или газов, содержащих SO2 либо H2S. Сера, полученная из газов, называется газовой серой. Сера - ценное сырье для получения серной кислоты, так как при сжигании ее образуется концентрированный газ с высоким содержанием SO2 и кислорода. Газ этот чистый (в самородной сере содержится незначительные количества мышьяка), при обжиге серы не остается огарка, поэтому схема переработки этого вида сырья на серную кислоту упрощается и является более экономичной. До 50% всей элементарной серы в мире расходуется на производство серной кислоты. Г) Сероводород. Большинство горючих газов (коксовый, генераторный, попутные, природные, газы нефтепереработки) содержат сероводород. Содержание H2S в этих газах не должно превышать 20 мг/м3 (ГОСТ 5542-50), поэтому их очищают промывкой поглотительными растворами (сода и др.). При нагревании такого раствора выделяется сероводород высокой концентрации (до 90% H2S). Он используется для серной кислоты. Д) Прочие виды сырья Для производства серной кислоты могут быть использованы также агломерационные, топочные и горючие газы и сырье, содержащее серу: гипс, фосфогипс, ангидрид, отработанные кислоты, травильные растворы, алуниты. Агломерационные газы - получаются при агломерации железной руды перед загрузкой в доменные печи. Агломерация состоит в продувке воздуха через раскаленную руду (с некоторыми добавками) для окисления содержащейся в руде серы и удаления ее из руды в виде SO2. Концентрация SO2 в таких газах составляет 0,5-1,5%, SO2 поглощают различными веществами со следующим выделением и них концентрированного SO2. Топочные и горючие газы содержат сернистый ангидрид или сероводород. SO2 образуется при сжигании в топках угля, содержащего серу. Например, газы теплоэлектроцентралей (ТЭЦ) содержат SO2, однако его концентрация в них очень низкая и выделение его требует больших затрат. Гипс CaSO4∙2H2O, ангидрид CaSO4 и фосфогипс (отходы в производстве фосфорной кислоты и фосфорных удобрений) сжигают с углем и глиной. При этом восстановление сульфата кальция сопровождается образованием SO2. Огарок измельчают и используют в качестве строительного материала (цемент). Отработанные кислоты получаются при сульфировании, очистке нефтепродуктов, осушке и др. Если отработанные кислоты не содержат вредных веществ, их можно использовать непосредственно в процессах (например, для изготовления удобрений). Если это невозможно, отработанные кислоты термически разлагают, а образующийся при этом SO2 используют для производства серной кислоты. Травильные растворы получаются при травлении металлов серной кислотой. Они содержат 2-4% серной кислоты и до 25% FeSO4. Серную кислоту этих растворов нейтрализуют избытком огарка и сульфат восстанавливают углем в печи. Образующийся сернистый ангидрид используют для производства серной кислоты. Алуниты K2SO4∙Al2(SO4)3∙2Al2O3∙6H2O обезвоживают и восстанавливают, при этом образуется SO2, используемый для производства серной кислоты и глинозем Al2O3, поступающий на производство алюминия.
3 ВЫБОР ТЕХНОЛОГИЧЕСКОЙ СХЕМЫ И ЕЕ ОБОСНОВАНИЕ
В настоящее время серная кислота производится двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце ХIХ и начале ХХ века. Контактный способ вытесняет нитрозный (башенный). Первой стадией сернокислотного производства по любому методу является получение диоксида серы при сжигании сернистого сырья. Контактным способом получают концентрированную серную кислоту и олеум (раствор трехокиси серы в серной кислоте), необходимые для многих потребителей. Другое важное достоинство этого способа - в возможности получения очень чистой кислоты, требующейся, в частности, для текстильной промышленности. Башенная кислота, получаемая нитрозным способом, содержит около 75% H2SO4, примеси окислов азота и значительный твердый остаток, поэтому она не может конкурировать с контактной серной кислотой. В контактном методе производства серной кислоты окисление диоксида серы в триоксид осуществляется на твердых контактных массах. Благодаря усовершенствованию контактного способа производства, себестоимость более чистой и высококонцентрированной контактной серной кислоты лишь незначительно выше, чем башенной. В настоящее время свыше 90% всей кислоты производится контактным способом. В качестве катализаторов контактного процесса теперь применяется термически стойкая ванадиевая контактная масса (в виде гранул и колец) с пониженной температурой зажигания. Проведены работы по освоению процесса окисления SO2 в кипящем слое катализатора. Важным усовершенствованием является двойное контактирование, при котором обеспечивается высокая степень окисления SO2 на катализаторе (до 99,8%) и потому исключается необходимость в дополнительной санитарной очистке отходящих газов. Выявлены важнейшие тенденции развития производства серной кислоты контактным способом: ) интенсификация процессов проведением их во взвешенном слое, применением кислорода, производством и переработкой концентрированного газа, применением активных катализаторов; ) упрощение способов очистки газа от пыли и контактных ядов (более короткая технологическая схема); ) увеличение мощности аппаратуры; ) комплексная автоматизация производства; ) снижение расходных коэффициентов по сырью и использование в качестве сырья серосодержащих отходов различных производств; ) обезвреживание отходящих газов.
1.3.1 Химическая система процесса Химическая схема процесса включает следующие стадии: Окисление дисульфида железа пиритного концентрата кислородом воздуха (сжигание серы). Контактное окисление SO2 в SO3. Абсорбция триоксида серы с образованием серной кислоты. Сжигание серы - окисление дисульфида железа пиритного концентрата кислородом воздуха. Обжиг колчедана в токе воздуха представляет собой необратимый некаталитический гетерогенный процесс, протекающий с выделением тепла через стадии термической диссоциации дисульфида железа: еS2 = 2FеS + S2
и окисления продуктов диссоциации: FеS + 7О2 = 2Fе2S3 + 4SО2
что описывается общим уравнением
FеS2 + 11О2 = 2Fе2S3 + 8SО2 (1)еS2 → Fе + S
При протекании реакции (1) помимо газообразного продукта реакции SO2 образуется твердый продукт Fe2O3, который может присутствовать в газовой фазе в виде пыли. Колчедан содержит различные примеси, в частности соединения мышьяка и фтора, которые в процессе обжига переходят в газовую фазу. Присутствие этих соединений на стадии контактного окисления диоксида серы может вызвать отравление катализатора. Поэтому реакционный газ после стадии обжига колчедана должен быть предварительно направлен на стадию подготовки к контактному окислению (вторая стадия), которая помимо очистки от каталитических ядов включает выделение паров воды (осушку), а также получение побочных продуктов (Se и Te). При сжигании серы протекает необратимая экзотермическая реакция (1) с выделением очень большого количества теплоты: изменение Н = -362,4 кДж/моль, или в пересчете на единицу массы 362,4/32=11,325 кДж/т = 11325 кДж/кг S. Расплавленная жидкая сера, подаваемая на сжигание, испаряется (кипит) при температуре 444,60С; теплота испарения составляет 288 кДж/кг. Как видно из приведенных данных, теплоты реакции горения серы вполне достаточно для испарения исходного сырья, поэтому взаимодействие серы и кислорода происходит в газовой фазе (гомогенная реакция). Контактное окисление SO2 в SO3. Контактное окисление диоксида серы является типичным примером гетерогенного окислительного экзотермического катализа. Это один из наиболее изученных каталитических синтезов. В СССР наиболее основательные работы по изучению окисления SO2 в SO3 и разработке катализаторов были проведены Г.К. Боресковым. Реакция окисления диоксида серы 2 + 0,5 O2 = SO3 (2)
характеризуется очень высоким значением энергии активации и поэтому практическое ее осуществление возможно лишь в присутствии катализатора. В промышленности основным катализатором окисления SO2 является катализатор на основе оксида ванадия V2O5 (ванадиевая контактная масса). Каталитическую активность в этой реакции проявляют и другие соединения, прежде всего платина. Однако, платиновые катализаторы чрезвычайно чувствительны даже к следам мышьяка, селена, хлора и других примесей и поэтому постепенно были вытеснены ванадиевым катализатором. Скорость реакции повышается с ростом концентрации кислорода, поэтому процесс в промышленности проводят при его избытке. Так как реакция окисления SO2 относится к типу экзотермических, температурный режим ее проведения должен приближаться к линии оптимальных температур. На выбор температурного режима дополнительно накладываются два ограничения, связанные со свойствами катализатора. Нижним температурным пределом является температура зажигания ванадиевых катализаторов, составляющая в зависимости от конкретного вида катализатора и состава газа 400-4400С, верхний температурный предел составляет 600-6500С и определяется тем, что выше этих температур происходит перестройка структуры катализатора, и он теряет свою активность. В диапазоне 400-6000С процесс стремятся провести так, чтобы по мере увеличения степени превращения температура уменьшалась. Абсорбция триоксида серы. Последней стадией процесса производства серной кислоты контактным способом является абсорбция триоксида серы из газовой смеси и превращение его в серную кислоту:
nSO3 + H2O = H2SO4 + (n-1)SO3+Q, (3)
если n > если n < 1, то получается разбавленная серная кислота. При выборе абсорбента и условий проведения стадии абсорбции необходимо обеспечить почти 100%-ное извлечение SO3 из газовой фазы. Для полного извлечения SO3 необходимо, чтобы равновесное парциальное давление SO2 над растворителем было ничтожно малым, так как при этом будет велика движущая сила процесса абсорбции. Однако, в качестве абсорбента нельзя использовать и такие растворы, над поверхностью которых велико равновесное парциальное давление паров воды. В этом случае еще не растворенные молекулы SO3 будут реагировать с молекулами воды в газовой фазе с образованием паров серной кислоты и быстро конденсироваться в объеме с образованием мельчайших капель серной кислоты, диспергированных в инертной газовой среде азоте, т.е. с образованием сернокислотного тумана: (г) + H2O(г) = H2SO4(г) + H2SO4(туман) ; Q>0.
Туман плохо улавливается в обычной абсорбционной аппаратуре и в основном уносится с отходящими газами в атмосферу, при этом загрязняется окружающая среда и возрастают потери серной кислоты. Высказанные соображения позволяют решить вопрос о выборе абсорбента. Важнейшей задачей в производстве серной кислоты является повышение степени превращения SO2 в SO3. Помимо увеличения производительности по серной кислоте выполнение этой задачи позволяет решить и экологические проблемы - снизить выбросы в окружающую среду вредного компонента SO2. Повышение степени превращения SO2 может быть достигнуто разными путями. Наиболее распространенный из них - создание схем двойного контактирования и двойной абсорбции.
1.3.2 Функциональная система Функциональная система - это совокупность последовательных технологических операций по превращению сырья - колчедана в продукт - контактную серную кислоту, представленная в виде схемы. Контактный способ производства серной кислоты - многостадийный процесс. В данной работе сырьем для производства серной кислоты контактным методом является серный колчедан (FeS2).
4 Описание технологической схемы
Схема получения серной кислоты контактным способом из колчедана состоит из 4-х основных стадий: Получение сернистого ангидрида, Очистка газа, содержащего сернистый ангидрид, от примесей, Окисление (на катализаторе) сернистого ангидрида до серного, Абсорбция серного ангидрида. К аппаратам первой стадии процесса относится обжиговая печь (2), в которой получают сернистый газ, и сухой электрофильтр (5), в котором обжиговый газ очищается от пыли. На вторую стадию процесса - очистку обжигового газа от примесей, ядовитых по отношению к катализатору, газ поступает при 300-4000С. Газ очищают, промывая его более холодной, чем сам газ, серной кислотой. Для этого последовательно газ пропускают через такие аппараты: промывные башни (6) и (7), первый мокрый электрофильтр (8), увлажнительную башню (9) и второй мокрый электрофильтр (8). В этих аппаратах газ очищается от мышьяковистого, серного и селенистого ангидридов, а также от остатков пыли. Далее газ освобождается от влаги в сушильной башне (10) и брызг серной кислоты в брызгоуловителе (11). Обе промывные башни (6) и (7), увлажнительная башня (9) и сушильная башня (10) орошаются циркулирующей серной кислотой. В цикле орошения есть сборники (20), из которых серная кислота насосами подается на орошение башен. При этом кислота предварительно охлаждается в холодильниках (18), где из промывных башен отводится в основном физическое тепло обжигового газа, а из сушильной - тепло разбавления сушильной серной кислоты водой. Нагнетатель (12) в этой схеме помещен примерно в середине системы, все аппараты, расположенные перед ним, находятся под разрежением, после него - под давлением. Таким образом, под давлением работают все аппараты, обеспечивающие окисление сернистого ангидрида до серного и абсорбцию серного ангидрида. При окислении сернистого ангидрида до серного выделяется большое количество тепла, которое используют для нагревания очищенного обжигового газа, поступающего в контактный аппарат (14). Горячий серный ангидрид через стенки труб, по которым он проходит в теплообменнике (13), передает тепло более холодному сернистому ангидриду, проходящему в межтрубном пространстве теплообменника (13) и поступающему в контактный аппарат (14). Дальнейшее охлаждение серного ангидрида перед абсорбцией в олеумном (16) и монигидратной (17) абсорберах происходит в ангидридном холодильнике (экономазере) (15). При поглощении серного ангидрида в абсорбционном отделении выделяется большое количество тепла, которое передается циркулирующей кислоте, орошающей олеумный (16) и моногидратный (17) абсорберы, и отводится в холодильниках (19) и (18). Концентрация олеума и моногидрата повышается вследствие поглощения все новых и новых порций серного ангидрида. Сушильная же кислота все время разбавляется из-за поглощения паров воды из обжигового газа. Поэтому для поддержания стабильных концентраций этих кислот существуют циклы разбавления олеума моногидратом, моногидрата - сушильной кислотой и цикл повышения концентрации сушильной кислотой моногидратом. Так как воды, поступающей в моногидратный абсорбер с сушильной кислотой, практически всегда недостаточно, чтобы получить нужную концентрацию кислоты, в сборник моногидратного абсорбера добавляют воду. 5 ОСНОВНЫЕ ФИЗИКО-ХИМИЧЕСКИЕ ПРОЦЕССЫ
Физико-химические основы процесса получения сернистого ангидрида Первой стадией процесса является окисление сырья с получением обжигового газа, содержащего диоксид серы. В зависимости от вида сырья протекают экзотермические химические реакции обжига:
4FeS2 +11O2 = 2Fe2O3 + 8SO2 (I) + O2 à SO2 (II)
При протекании реакции (I) помимо газообразного продукта реакции SO2 образуется твердый продукт Fe2O3, который может присутствовать в газовой фазе в виде пыли. Колчедан содержит различные примеси, в частности соединения мышьяка и фтора, которые в процессе обжига переходят в газовую фазу. Присутствие этих соединений на стадии контактного окисления диоксида серы может вызвать отравление катализатора. Поэтому реакционный газ после стадии обжига колчедана должен быть предварительно направлен на стадию подготовки к контактному окислению (вторая стадия). Суммарную реакцию обжига колчедана можно представить в виде реакции (I), где ∆Н=-853,8 кДж⁄моль FeS2, или 7117 кДж ⁄кг. Фактически она протекает через несколько последовательно-параллельных стадий. Сначала происходит медленная эндотермическая реакция термического разложения дисульфида железа, а затем начинаются сильно экзотермические реакции горения паров серы и окисления сульфида железа FeS. Часть кислорода воздуха расходуется в реакции на окисление железа и поэтому максимально возможная концентрация диоксида серы в обжиговом газе в этом случае ниже, чем при сжигании серы. Колчедан, применяемый для обжига, предварительно обогащают флотацией. Флотационный колчедан кроме пирита FeS2 содержит ряд примесей (в частности, соединения мышьяка, селена, теллура, фтора), которые при обжиге переходят в состав обжигового газа в виде оксидов As2O3, SeO2, TeO2 и фторсодержащих газообразных соединений HF, SiF4. Наличие этих соединений обусловливает необходимость последующей очистки газа. Обжиг колчедана - типичный гетерогенный процесс в системе «газ - твердое», который можно описать моделью с фронтальным перемещением зоны реакции. В соответствии с этой моделью процесс включает ряд диффузионных стадий и саму химическую реакцию, также многостадийную. Для увеличения скорости процесса стремятся прежде всего уменьшить сопротивление диффузионных стадий, т. е. не проводить обжиг колчедана в диффузионной области. Это может быть достигнуто измельчением твердой фазы и интенсивной турбулизацией потока. Наиболее удобным аппаратом для этой цели является печь «кипящего слоя» КС. Температура процесса должна быть достаточно большой для обеспечения высокой скорости реакции. При низких температурах (ниже 500˚C) не может протекать эндотермическая реакции термического разложения дисульфида железа. Однако проведение обжига при очень высоких температурах может вызвать нежелательный физический процесс спекания частиц горящего материала, приводящий к увеличению их размеров. Температура спекания колеблется в зависимости от состава (сорта) колчедана в пределах от 800 до 900˚C. В настоящее время в сернокислой промышленности для обжига колчедана применяют в основном печи кипящего слоя с псевдоожиженным слоем твердого материала. В псевдоожиженном слое обеспечивается высокая скорость диффузионных и теплообменных процессов (подвод кислорода к поверхности колчедана, отвод диоксида серы в газовый поток, отвод теплоты от поверхности сырья к газовому потоку). Отсутствие тормозящего влияния масс - и теплообмена позволяет проводить обжиг колчедана в таких печах с высокой скоростью. Печи КС характеризуются максимальной интенсивностью в сравнение с другими конструкциями, применяемые для обжига колчедана. К недостаткам печей КС можно отнести высокую запыленность обжигового газа. Физико-химические основы процесса очистки Перед подачей обжигового газа в контактный аппарат необходимо отделить примеси, являющиеся ядами для контактной массы (мышьяк, фтор), или примеси, присутствие которых при контактировании нежелательно (пыль, пары воды), а также извлечь ценные металлы (селен, теллур и др.). Наличие пыли в газе приводит к снижению качества выпускаемой кислоты. Пары воды не являются ядом для контактной массы, но соединяясь с некоторым количеством серного ангидрида, всегда содержащимся в обжиговом газе, образуют пары серной кислоты. Пары серной кислоты при понижении температуры газовой смеси из-за соприкосновения с более холодной промывной кислотой в башне (6) конденсируются в объеме, образуя взвесь мельчайших капелек серной кислоты в газе (туман серной кислоты). Этот туман при прохождении газа через аппараты медленно осаждается на их стенках, вызывая коррозию, повышая гидравлическое сопротивление и снижая коэффициенты теплопередачи. Наибольшее разрушительное действие производит туманообразная серная кислота в контактном отделении. Продукты коррозии, образующиеся при взаимодействии серной кислоты с металлом труб контактных аппаратов, подогревателей и теплообменников, увеличивают сопротивление аппаратуры, уменьшают коэффициенты теплоотдачи и вызывают отложение твердых корок на первых слоях контактной массы. В результате коррозии получается сульфат железа, который газовым потоком уносится в контактный аппарат. Под действием сульфата железа на верхних слоях контактной массы образуются твердые корки, изолирующие большую часть поверхности контактной массы и повышающие сопротивление слоя. Поэтому образующийся туман серной кислоты перед подачей газа в контактный аппарат должен быть тщательно отделен от газовой смеси. Оксиды селена (Se) и мышьяка (As) присутствуют в обжиговом газе в виде паров. При понижении температуры газовой смеси в промывных башнях пары мышьяковстого и селенистого ангидридов тумана не образуют. Они частично конденсируются на поверхности орошаемой кислоты и растворяются в ней. Таким образом, туман серной кислоты, подлежащий выделению перед контактным аппаратом, содержит мышьяк и селен. Осаждая этот туман на электрофильтрах, газ очищают от вредных примесей. Огарковая пыль почти полностью осаждается из обжигового газа при очистке газа в очистной аппаратуре. Присутствующие в обжиговом газе фтористый водород HF и четыреххлористый кремний SiFe4 по-разному отмываются серной кислотой. HF плохо растворяется в кислоте. Лишь при концентрации H2SO4 более 95% и температуре ниже 800С растворимость HF возрастает настолько, что очистка газа возможна до содержания в нем HF 3 мг/м3. SiFe4 хорошо растворяется в серной кислоте при концентрации менее 60% H2SO4. Если в газе присутствует большое количество фтористого водорода, разрушаются футеровка и насадки промывных башен в результате взаимодействия HF с кремнеземом, входящим в состав футеровочных материалов и насадки. Поэтому при использовании серного сырья, содержащего много фтора, футеровки и насадки должны быть выполнены из графитовых материалов, иначе фтор необходимо выводить из системы каким-либо способом. В кислоте, вытекающей из первой промывной башни, содержится до 1% (20 г/л) As2O3. При охлаждении этой кислоты часть мышьяка выпадает в осадок, который засоряет холодильники, оседает на стенках сборников и кислотопроводов. Осушка обжигового газа - это очистка его от паров воды. Хотя пары воды безвредны для контактной массы, присутствие их в газе, поступающем на абсорбцию серного ангидрида, приводит к образованию тумана в абсорбционном отделении. При этом уменьшается коэффициент использования серы, значительное количество ее оказывается в выбросах. Поэтому пар перед абсорбцией очищают от паров воды. Для этого газ направляют в сушильную башню с керамической насадкой, орошаемой концентрированной серной кислотой. Содержание паров воды в газе, поступающем в сушильную башню, определяется температурой газа после увлажнительной башни. На выходе из сушильной башни содержание влаги не должно превышать 0,08 г/м3. Температуру газа перед сушильными башнями поддерживают такой, чтобы содержание влаги в газе не превышало количества воды, необходимого для образования в абсорберах серной кислоты заданной концентрации. При получении улучшенной серной кислоты всю воду, необходимую для абсорбции SO3, желательно вводить в систему в виде водяных паров, поглощаемых из сернистого газа в сушильных башнях. При этом насыщение газа водяными парами производят в увлажнительной башне, а при конденсации этих паров получается чистая дистиллированная вода. При осушке газа концентрированной серной кислотой происходит процесс абсорбции паров воды. В процессе участвуют две фазы: газовая и жидкая, и газовая фаза переходит в жидкую. С повышением концентрации сушильной кислоты от 93 до 97% H2SO4 потери сернистого ангидрида увеличиваются в 6 раз, а при понижении температуры от 60 до 400С - примерно в 1,5 раз. Физико-химические процессы окисления сернистого ангидрида до серного Процесс окисления сернистого ангидрида до серного протекает по реакции:
SO2+O2↔SO3+ΔH, где ΔH - тепловой эффект реакции.
Процесс окисления SO2 проводят на ванадиевом катализаторе при высокой температуре. При этом нагревание газа до заданной температуры связано с большими затратами топлива, поэтому на практике поступают следующим образом. Нагревают газ до температуры, при которой процесс начинает протекать в достаточной для практических целей скоростью и направляют его на первый слой катализатора. При окислении SO2 выделяется тепло, за счет которого повышается температура газа по прямолинейному закону. Скорость реакции повышается с ростом концентрации кислорода, поэтому процесс в промышленности проводят при его избытке. На первом слое катализатора процесс ведут так, чтобы температура газа на выходе из этого слоя была несколько выше, чем на входе. Затем газ направляют в теплообменник, где он охлаждается. После этого газ направляют на второй слой катализатора, где он вновь нагревается по прямолинейному закону за счет тепла реакции, затем газ охлаждают и направляют на третий слой катализатора, так поступают до тех пор, пока степень превращения не достигнет заданного значения. Так как реакция окисления SO2 относится к типу экзотермических, температурный режим ее проведения должен приближаться к линии оптимальных температур. На выбор температурного режима дополнительно накладываются два ограничения, связанные со свойствами катализатора. Нижнем температурным пределом является температура зажигания ванадиевых катализаторов, составляющая в зависимости от конкретного вида катализатора и состава газа 400-440˚C. Верхний температурный предел составляет 600-650˚C и определяется тем, что выше этих температур происходит перестройка структуры катализатора и он теряет свою активность. В диапазоне 400-600˚C процесс стремятся провести так, чтобы по мере увеличения степени превращения температура уменьшалась. Реакция окисления SO2 до SO3 идет в присутствии катализатора. Ранее в качестве катализатора при получении контактной серной кислоты применяли платину. Теперь она полностью вытеснена ванадиевым катализатором, более дешевым и менее чувствительным к ядам (мышьяк, селен, хлор и др.). Увеличение давления оказывает на реакцию превращения SO2 в SO3 благоприятное действие, поскольку в результате реакции из 1 ½ молекулы получается одна, т.е. происходит сокращение объема.
Состав газа также влияет на реакцию окисления SO2 до SO3, а именно: понижение концентрации сернистого ангидрида и увеличение концентрации кислорода повышает степень превращения SO2 в SO3 . Все перечисленные факторы (давление, температура, состав газа, тип катализатора) определяют скорость реакции превращения сернистого ангидрида в серный. От скорости реакции окисления зависит требуемый объем катализатора, а следовательно, и объем контактного аппарата. Чтобы процесс был экономичным, его стремятся вести при наибольшей скорости реакции. Одна из важнейших задач стоящих перед сернокислой промышленностью, - увеличение степени превращения диоксида серы и снижения его выбросов в атмосферу. Эта задача может быть решена несколькими методами. Один из наиболее рациональных методов решения этой задачи, повсеместно применяемый сернокислой промышленности, - метод двойного контактирования и двойной абсорбции (ДКДА). Его сущность состоит в том, что реакционную смесь, в которой степень превращения SO2 составляет 90-95%, охлаждают и направляют в промежуточный абсорбер для выделения SO3. В оставшемся реакционном газа соотношение O2: SO2 существенно повышается, что приводит к смещению равновесия реакции вправо. Вновь нагретый реакционный газ снова подают в контактный аппарат, где на одном - двух слоях катализатора достигают 95% степени превращения оставшегося SO2. Суммарная степень превращения SO2 составляет в таком процессе 99,5-99,8%. Физико-химические процессы абсорбции серного ангидрида Абсорбция серного ангидрида из газовой смеси - последняя стадия процесса получения контактной серной кислоты. H2O = H2SO4 + (n-1)SO3+Q, (3)
если n > 1, то получается олеум (раствор SO3 в H2SO4), если n = 1 , то получается моногидрат (98,3% H2SO4), если n < 1, то получается разбавленная серная кислота. Последней стадией процесса производства серной кислоты контактным способом является абсорбция триоксида серы из газовой смеси и превращение его в серную кислоту. При выборе абсорбента и условий проведения стадии абсорбции необходимо обеспечить почти 100%-ное извлечение SO3 из газовой фазы. Для полного извлечения SO3 необходимо, чтобы равновесное парциальное давление SO3 над растворителем было ничтожно малым, так как при этом будет велика движущая сила процесса абсорбции. Однако в качестве абсорбента нельзя использовать и такие растворы, над поверхностью которых велико равновесное парциальное давление паров воды. В этом случае еще не растворенные молекулы SO3 будут реагировать с молекулами воды в газовой фазе с образованием паров серной кислоты и быстро конденсироваться в объеме с образованием мельчайших капель серной кислоты. Серный ангидрид полнее всего поглощается 98,3% серной кислотой. Если серная кислота более разбавлена, то над ней в газовой фазе есть пары воды. Часть серного ангидрида соединяется с этими парами, образуя пары серной кислоты, которые при охлаждении конденсируются с образованием сернокислотного тумана.
SO3(Г) + H2O(Г) à H2SO4(Г) à H2SO4(ТУМАН); ∆Η < 0
Туман плохо улавливается в обычной абсорбционной аппаратуре и в основном уносится с отходящими газами в атмосферу, при этом загрязняется окружающая среда и возрастают потери серной кислоты. Если концентрация кислоты, орошающей абсорбер, выше 98,3%, то степень поглощения снижается. В обоих случаях образуется туман, и степень абсорбции серного ангидрида снижается. Таким образом, для обеспечения высокой степени поглощения следует поддерживать в абсорбере концентрацию серной кислоты, близкую к 98,3%, а температуру ниже 100˚C. Однако в процессе абсорбции SO3 происходит закрепление кислоты (повышение ее концентрации) и в силу экзотермичности реакции увеличивается температура. Для уменьшения тормозящего влияния этих явлений абсорбцию ведут так, чтобы концентрация H2SO4 при однократном прохождении абсорбера повышалась только на 1 - 1,5%, закрепившуюся серную кислоту разбавляют в сборнике до концентрации 98,3%, охлаждают в наружном холодильнике и вновь подают на абсорбцию, обеспечивая высокую кратность циркуляции. Повышение температуры также снижает степень абсорбции. Осушенный газ, содержащий SO3, проходит последовательно олеумный и моногидратный абсорберы, орошаемые кислотой. Серный ангидрид поглощается из газа этой кислотой, а остальная часть газа выбрасывается в атмосферу. Тепло реакции, выделяющееся при абсорбции и поглощаемое орошаемой кислотой, отводится в холодильники. Вывод продукционной серной кислоты в контактной системе производят в виде олеума из олеумного абсорбера и в виде контактной кислоты. Для этого в одной из сушильных башен поддерживают концентрацию кислоты, соответствующую стандартным требованиям на контактную техническую серную кислоту, и по мере накопления передают кислоту из сборника на склад.
6 АВТОМАТИЗАЦИЯ ОСНОВНЫХ ПАРАМЕТРОВ ТЕХНОЛОГИЧЕСКОЙ СХЕМЫ серный кислота контактный химический Автоматизация - одна из ведущих отраслей науки и техники, развивается особенно динамично, она проникает во все сферы человеческой деятельности. Автоматизация качественно изменяет характер труда рабочих. Автоматизация сернокислотных заводов включает: а) централизацию автоматического контроля производства; б) автоматическое регулирование основных параметров технологического процесса; в) дистанционное управление отдельными регулирующими органами и агрегатами; г) сигнализацию предельных значений наиболее важных параметров технологического процесса; д) блокировку отдельных механизмов транспортирования колчедана и огарка в печном отделении. Автоматический контроль на действующих контактных заводах серной кислоты централизуется по отдельным узлам (отделениям) технологического процесса (отделение сушки колчедана, печное отделение, контактное, сушильно-абсорбционное) и по сернокислотному цеху в целом. На центральном щите сосредотачиваются приборы контроля наиболее важных параметров технологического процесса (концентрация газа после печного отделения и на входе в контактные аппараты, температуры газа на входе в сушильную башню и т. д.). Кроме того, на этом щите сосредоточены приборы контроля расходов основных потоков сырья (колчедана, серы, газа) и расхода электроэнергии, пара, воды. Полная автоматизация цеха, производящего контактную серную кислоту из колчедана по классической схеме, затруднительная из-за громоздкости аппаратурного оформления и необходимости часто ремонтировать такие аппараты, как холодильники, насосы и др. Экономически наиболее эффективна автоматизация контактных систем, более простых по аппаратурному оформлению, так как в них отсутствует промывное отделение и можно упростить процесс окисления SO2 и абсорбции SO3. При автоматизации процесса тщательно продумывают количество контролируемых параметров, сокращая их до минимума, но так, чтобы иметь все необходимые параметры, определяющие режим системы. Этого требует экономическая сторона вопроса, так как установка приборов контроля и регулирования связана с большими капитальными затратами. Автоматизация обжига колчедана. Одним из важнейших показателей производства серной кислоты является постоянство объема обжигового газа и концентрации SO2 в нем. Постоянство объема газа поддерживают путем подачи в печь постоянного количества воздуха. Труднее достигнуть стабильности содержания SO2 в газе. Это связано с количеством поступающего в печь сырья (загрузкой), степенью его измельчения, содержанием в нем серы, условиями обжига и т.д. Автоматически регулируют концентрацию SO2 в сернистом газе при помощи газоанализатора, измеряющего концентрацию сернистого ангидрида и посредством соответствующих устройств воздействующего на питатель колчедана, изменяя таким образом его количество, поступающее в печь. Иногда концентрацию SO2 в газе регулируют путем изменения количества подаваемого в печь колчедана по температуре в печи или газа после печи, так как концентрация сернистого ангидрида и температура газа взаимно связаны. Однако такое регулирование менее точно, чем непосредственно по концентрации газа, так как его температура зависит не только от содержания SO2, но и от температуры поступающего в печь воздуха, влажности колчедана и др. Кроме того, вследствие разогрева футеровки печи и газоходов изменение температуры газов несколько отстает от изменения концентрации в нем SO2, что также влияет на степень регулирования. Автоматизация промывного отделения В промывном отделении кислота, накапливающаяся в мокрых электрофильтрах и увлажнительной башне, передается последовательно во вторую, а из нее в первую промывную башни. Концентрация кислот увлажнительной и второй промывной башен определяется концентрацией кислоты в первой башне, температурным режимом, особенностями аппаратов и другими условиями. При автоматизации промывного отделения в зависимости от концентрации кислоты в первой промывной башне, измеряемой концентратомером, изменяется количество воды, поступающей в сборник увлажнительной (или второй промывной) башен. Температурный режим поддерживается автоматическим регулированием количества воды, охлаждающей поверхность холодильников кислоты. Автоматизация сушильно-абсорбционного отделения Здесь автоматизация предусматривает регулирование взаимного обмена кислот и откачку на склад продукции. Автоматизация контактного отделения Температурный режим контактного аппарата необходимо поддерживать с точностью ±(2-30С). Тогда при заданном количестве газа и определенном содержании в нем SO2 можно получить наиболее высокую степень окисления SO2 до SO3. Автоматизация контактного отделения дает возможность регулировать температуру газа и концентрацию SO2 со следующей точностью: Температура газа, 0С: на входе в аппарат…………………………………………..±0,5 на выходе из первого слоя контактной массы……………±2,0 Концентрация SO2, %.......................................................................±0,3 При ручном управлении наибольшие отклонения температуры газа от норм составляют на входе в аппарат 10-15, на выходе из первого слоя 15-200С. При автоматизации контактного аппарата можно повысить общую степень окисления на 0,75%. Возможна также комплексная автоматизация всего цеха и создание цехов-автоматов, работающих без участия обслуживающего персонала. Это реальное будущее химической промышленности.
7 ТЕХНИКА БЕЗОПАСНОСТИ И ОХРАНА ТРУДА
На сернокислотном производстве возможны случаи отравления сернистым газом, окислами азота или туманообразной серной кислотой, химических ожогов серной кислотой и термических ожогов при соприкосновении с горячими поверхностями аппаратуры, не исключена также опасность поражения электрическим током. Сернистый ангидрид вызывает раздражение кожи, слизистых оболочек носа, глаз и верхних дыхательных путей. При содержании в воздухе 0,06 мг/л SO2 возможны острые отравления, сопровождающиеся отеком легких и расширением сердца. Чтобы избежать отравлений при аварийном выделении сернистого газа, необходимо надевать фильтрующие противогазы. Пострадавшего от отравления надо немедленно вынести на свежий воздух, дать кислород и ввести внутрь слабый раствор соды, немедленно вызвать врача. Серный ангидрид, соединяясь с парами воды, образует туман, который затрудняет дыхание. Предельная допустимая концентрация серного ангидрида и серной кислоты в воздухе рабочей зоны производственных помещений 1 мг/м3. Серная кислота оказывает сильное действие на организм человека. При соприкосновении с кожей она вызывает местное омертвление и разрушение тканей. С ней надо обращаться очень осторожно. К работе следует приступать только в исправной спецодежде (суконная куртка и брюки), спецобуви (резиновые сапоги) и в резиновых перчатках, глаза должны быть защищены предохранительными очками. Необходимо иметь при себе противогаз. При смешивании серной кислоты с водой следует серную кислоту вливать в воду, а не наоборот. При попадании серной кислоты на тело и в глаза, надо быстро смыть ее большим количеством воды, затем смочить пораженные участки 5% содовым раствором. Избыток воды обязателен, так как при небольшом количестве воды ожог может усилиться. Врача вызывать обязательно. Необходимо полностью устранить опасность падения в сборники и резервуары с серной кислотой, они должны быть закрыты крышками, а там, где это невозможно по техническим условиям, тщательно ограждены. В отделении сушки колчедана все движущиеся части механизмов сушильной установки должны иметь надежные ограждения. Сухой флотационный колчедан сильно пылит, поэтому в помещениях должна быть хорошая вентиляция. Поэтому рабочим в отделении сушки необходимо иметь при себе противогазы. При оборудовании печного отделения механическими печами во избежание несчастных случаев все работы в печи можно производить только при выключении аппаратов. Необходимо регулярно смазывать движущиеся механизмы печей (подшипники, шестерни) и другой аппаратуры. В отделении электроочистки электрический ток при неосторожном обращении представляет большую опасность для человека. Электрический удар может вызвать общее поражение всего организма. Следует знать: чем дольше человек находится под воздействием тока, тем сильнее поражается его организм. Для предотвращения поражения каждый рабочий на производстве должен хорошо знать и строго соблюдать правила техники безопасности, в частности, не прикасаться незащищенными руками к оголенным проводам, находящимся под током, не ремонтировать приборы, не имея специального допуска, включать электродвигатели необходимо только в резиновых перчатках. Ремонт аппаратуры должен проводиться только при выключенном токе и правильном заземлении. Все двери в помещения, где расположены аппараты и провода высокого напряжения, должны быть закрыты и снабжены блокировкой. В контактном отделении следует соблюдать общие правила обращения с серной кислотой. Работающим в контактном отделении необходимо иметь при себе противогазы. Прежде чем осматривать изнутри стальные сборники кислоты (и железнодорожные цистерны), в которых была кислота, надо убедиться в том, что они хорошо проветрены. Строго запрещается при этом зажигать огонь, так как серная кислота, взаимодействуя с железом, выделяет водород, который с воздухом образует взрывчатую смесь. Чтобы на производстве исключить несчастные случаи, разработаны нормы и правила безопасности. Проводится инструктаж на каждом рабочем месте. К работе с сернокислотных цехах допускаются только лица, прошедшие медицинский осмотр и сдавшие техминимум для данного производства. Инструкции по технике безопасности должны быть разработаны для каждого рабочего места. Проверка знаний техники безопасности проводится не реже одного раза в полугодие. Применяемая на рабочих местах спецодежда должна также соответствовать нормам. Непрерывность процесса производства серной кислоты и тесная взаимосвязь отдельных стадий производства требует обеспечения хорошей связи (сигнализация, телефон и радиофикация) рабочих мест между собой и начальником смены. 1.8 ЗАКЛЮЧЕНИЕ
В производстве H2SO4 соблюдены основные направления развития химической промышленности: Эта химическая технология обладает рядом функций: üРациональное использование сырья и энергии.
üМасштабность и дешевизна.
Поскольку процесс непрерывен, он обладает рядом достоинств: ØБольшое количество продукта с 1 объема аппарата - высокая интенсивность процесса.
ØИсключение потерь тепла из-за термодинамичности - нагрев-охлаждение.
ØЛегкость автоматизации.
Также процесс учитывает основные принципы химической технологии: Важнейшей задачей в производстве серной кислоты является повышение степени превращения SО2 в SО3. Помимо увеличения производительности по серной кислоте выполнение этой задачи позволяет решить и экологические проблемы - снизить выбросы в окружающую среду вредного компонента SО2. Повышение степени превращения SО2 может быть достигнуто разными путями. Наиболее распространенный из них - создание схем двойного контактирования и двойной абсорбции. ЛИТЕРАТУРА
1.Касаткин А.Г. Основные процессы и аппараты химической технологии. Изд.7. - М.: Госхимиздат, 1970.
2.Амелин А.Г. Технология серной кислоты. - М.: Химия, 1971.
.Васильев Б.Т., Отважная М.И. Технология серной кислоты. - М.: Химия, 1985. - 385 с.
.Справочник сернокислотчика / Под ред. К.М.Малинина. - М., 1971.
.Гайдай С.Г., Лазинцев Д.Н. Техника безопасности при ремонте и монтаже оборудования в химической промышленности. - М.: Профиздат, 1989.
Получение серной кислоты из железного колчедана
Вторую стадию производства серной кислоты - окисление SO2 в SOз - проводят контактным или нитрозным методами. Примерно 80% мирового производства серной кислоты осуществляется контактным способом. Этот способ известен с 1900 г.
Серная кислота – один из основных много тоннажных продуктов химической промышленности. Ее применяют в различных отраслях народного хозяйства, поскольку она обладает комплексом особых свойств, облегчающих ее технологическое использование. Серная кислота не дымит, не имеет цвета, запаха, при обычной температуре находится в жидком состоянии. В концентрированном виде не корродирует черные металлы. В то же время серная кислота относится к числу сильных минеральных кислот, образует многочисленные устойчивые соли и дешева.
Высокая активность серной кислоты в сочетании со сравнительно небольшой стоимостью производства предопределило большие масштабы и чрезвычайное разнообразие ее применения. Среди минеральных кислот серная кислота по объему производства и потребления занимает первое место. Мировое производство ее составляет более 160 млн. т. в год. Области применения серной кислоты и олеума весьма разнообразны. Значительная часть ее используется в производстве минеральных удобрений (от 30 до 60 %), многие кислоты (фосфорная, уксусная, соляная) и соли производятся в значительной части при помощи серной кислоты. Серная кислота широко применяется в производстве цветных и редких металлов, а также в производстве красителей (от 2 до 16 %), химических волокон (от 5 до 15 %) и металлургии (от 2 до 3 %). Она применяется для различных технологических целей в текстильной, пищевой и других. На рисунке представлены области применения серной кислоты и олеума.
Безводная серная кислота (моногидрат) Н 2 SО 4 представляет собой тяжелую маслянистую жидкость, которая смешивается с водой во всех соотношениях с выделением большого количества тепла. Плотность серной кислоты при 0 0 С равна 1.85 г./см 3 . Она кипит при Т = 296 0 С и замерзает при -10 0 С. Серной кислотой называют не только моногидрат, но и водные растворы его (Н 2 SО 4 + nН 2 О), а также растворы серного ангидрида в моногидрате (Н2БО4 + пБО3), называемые олеумом. Олеум на воздухе «дымит» вследствие десорбции из него БО 3 . Чистая серная кислота бесцветна, техническая окрашена примесями в черный цвет.
Н 2 SО 4 *(n‑1) SО 3 ← Н 2 SО 4 → Н 2 SО 4 * (m -1) Н 2 О
Олеум моногидрат водная кислота
При m = n =1 это моногидрат, при m >n – водные растворы, при m
Эти гидраты и соединения с оксидом серы имеют различные температуры кристаллизации и образуют ряд эвтектик. Некоторые из этих эвтектик имеют температуру кристаллизации ниже нуля или близкие к нулю. Эти особенности растворов серной кислоты учитываются при выборе ее товарных сортов, которые по условиям производства и хранения должны иметь низкую температуру кристаллизации. Для транспортировки, применения серной кислоты большое значение имеет изменение температуры плавления и температуры ее кипения в зависимости от концентрации. При возрастании концентрации от 0% Н 2 SО 4 до 64.35 % SО3 (своб) последовательно образуется шесть гидратов, являющихся индивидуальными химическими соединениями, которые взаимно нерастворимы в твердом виде. В области концентраций SО 3 от 64.36 % до 100 % при кристаллизации образуются твердые растворы. В зимнее время при низких температурах нельзя производить и применять кислоту с концентрацией, близкой к чистому SО 3 ; 2SО 3 * Н 2 О; SО 3 *Н 2 О, так как из этих растворов могут выпадать кристаллы, которые забьют кислотопроводы между цехами, хранилища, насосы.
Пары серной кислоты при повышении температуры диссоциируют
Н 2 SО 4 → Н 2 О +SО 3
и при температурах выше 400 0 С уже содержат больше молекул SО 3 , чем Н 2 SО 4
2Н 2 SО 4 ↔2Н 2 О + 2 SО 3 ↔2SО 3 + 2 Н 2 О +О 2
Серная кислота весьма активна. Она растворяет оксиды металлов и большинство металлов; вытесняет при повышенной температуре все другие кислоты из солей. Она отнимает воду от других кислот, от кристаллогидратов солей. Дерево и другие растительные и животные ткани, содержащие целлюлозу, крахмал и сахар, разрушаются под действием концентрированной серной кислоты, вода связывается с кислотой и от ткани остается лишь мелкодисперсный углерод. В разбавленной кислоте целлюлоза и крахмал распадаются с образованием сахаров. При попадании на кожу человека концентрированная серная кислота вызывает ожоги.
Еще в 13 веке серную кислоту получали термическим разложением железного купороса FеSО 4 , поэтому и сейчас один из сортов серной кислоты называют купоросным маслом, хотя давно уже серная кислота не производится из купороса. Ныне серная кислота производится двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце 19 и начале 20 века. Контактный способ вытесняет нитрозный (башенный).
Первой стадией сернокислотного производства по любому методу является получение сернистого газа при сжигании сернистого сырья. После очистки сернистого газа (особенно в контактном способе) его окисляют до серного ангидрида, который, соединяясь с водой, образует серную кислоту. Окисление SО 2 в SО 3 протекает крайне медленно. Для ускорения процесса применяют катализаторы.
В контактном методе окисление сернистого ангидрида в серный осуществляется на твердых контактных массах. Благодаря усовершенствованию контактного способа производства себестоимость более чистой и высококонцентрированной серной кислоты лишь незначительно выше, чем башенной. В н.в. около 80 % всей кислоты производится контактным способом.
В нитрозном способе катализатором служат оксиды азота. Окисление БО 2 происходит, в основном, в жидкой фазе и осуществляется в башнях с насадкой. Поэтому нитрозный способ по аппаратурному признаку называют башенным. Сущность башенного способа заключается в том, что полученный при сжигании сернистого сырья сернистый газ, содержащий примерно 9% SО 2 и 9-10% О 2 , очищается от пыли и поступает в башенную систему, состоящую из нескольких башен с насадкой. В башнях протекает ряд абсорбционно-десорбционных процессов, осложненных химическими превращениями. В первых двух-трех башнях насадка орошается нитрозой, в которой растворенные оксиды азота химически связаны в виде нитрозилсерной кислоты КОНSО 4 . В последующих трех – четырех башнях десорбированные в газовую фазу в результате реакции окислы азота поглощаются серной кислотой, образуя вновь нитрозилсерную кислоту. Таким образом, окислы азота совершают кругооборот и теоретически не должны расходоваться. Нитрозным способом получают загрязненную примесями и разбавленную 70–75 % серную кислоту, которая используется в основном в производстве минеральных удобрений.
Сырьем в производстве серной кислоты могут быть элементарная сера и различные серосодержащие соединения, из которых могут быть получена сера или непосредственно оксид серы.
Природные залежи самородной серы невелики. Чаще всего сера находится в природе в форме сульфидов и сульфатов металлов, а также входит в состав нефти, каменного угля, природного газа. Значительные количества серы содержатся в виде оксида серы в топочных газах и газах цветной металлургии и в виде сероводорода, выделяющегося при очистке горючих газов. Таким образом, сырьевые источники производства серной кислоты достаточно многообразны, хотя до сих пор в качестве сырья используют преимущественно элементарную серу и железный колчедан. Ограниченное использование таких видов сырья, как топочные газы ТЭС и газы медеплавильного производства, объясняется низкой концентрацией в них оксида серы (4). При этом доля колчедана в балансе сырья уменьшается, а доля серы возрастает.
В общей схеме сернокислотного производства существенное значение имеют две первые стадии – подготовка сырья и его сжигание или обжиг. Их содержание и аппаратурное оформление существенно зависят от природы сырья, которая в значительной степени, определяет сложность технологического производства серной кислоты.
1. Железный колчедан.
Природный железный колчедан представляет сложную породу, состоящую из сульфида железа РеБ 2 , сульфидов других металлов (меди, цинка, свинца и др.), карбонатов металлов и пустой породы. В РФ залежи колчедана имеются на Урале и Кавказе, где его добывают в рудниках в виде рядового колчедана. Процесс подготовки рядового колчедана к производству ставит целью извлечение из него ценных цветных металлов и повышение концентрации дисульфида железа.
Чистый пирит содержит 53.5% серы и 46.5% железа. В серном колчедане содержание серы обычно колеблется от 35 до 50%, железа от 30 до 40%, остальное составляют сульфиды цветных металлов, углекислые соли, песок, глина и др.
Схема подготовки рядового колчедана представлена на рисунке.
кислота серный сырье химический
На основе материального баланса рассчитываются расходные коэффициенты, определяются размеры аппаратов и устанавливаются оптимальные значения параметров технологического режима процесса.
2. Сера.
Элементарная сера может быть получена из серных руд или газов содержащих сероводород или оксид серы. В соответствии с этим различают серу самородную и серу газовую комовую:

На территории РФ залежей самородной серы практически нет. Источником газовой серы являются Астраханское газоконденсатное месторождение, Оренбургское и Самарское месторождения попутного газа.
Из самородных руд серу выплавляют в печах, автоклавах или непосредственно в подземных залежах (метод Фраша). Для этого серу расплавляют непосредственно под землей, нагнетая в скважину перегретую воду, и выдавливают расплавленную серу на поверхность сжатым воздухом.
Схема подготовки самородной серы
Получение газовой серы из сероводорода, извлекаемого при очистке горючих и технологических газов, основано на процессе неполного его окисления над твердым катализатором. При этом протекают реакции:

3. Сероводород .
Источником сероводорода служат различные горючие газы: коксовый, генераторный, попутный, газы нефтепереработки. Извлекаемый при их очистке газ, содержит до 90 % сероводорода и не нуждается в специальной подготовке.
Доля сырья в себестоимости продукции сернокислотного производства достаточно велика. Поэтому технико-экономические показатели этого производства существенно зависят от вида используемого сырья. В таблице приведены основные ТЭП производства серной кислоты из различного сырья (за 100 % взяты показатели производства на основе железного колчедана).
| Сырье | ||||
| показатели | Железный колчедан | Самородная сера | Газовая сера | Сероводород |
| Удельные капиталовложения в производство | 100 | 57 | 57 | 63 |
| Себестоимость кислоты | 100 | 125 | 67 | 80 |
| Приведенные затраты | 100 | 118 | 75 | 72 |
Замена колчедана серой приводит к снижению капитальных затрат на строительство и улучшению экологической обстановки в результате ликвидации отвалов огарка и уменьшению выбросов токсичных веществ в атмосферу. Вследствие сложностей с транспортом серной кислоты сернокислотные заводы располагаются преимущественно в районах ее потребления.
Поэтому производства серной кислоты развито во всех экономических районах РФ. Важнейшими центрами его являются: Щелково, Новомосковск, Воскресенск, Держинск, Березняки, Пермь.
Производство серной кислоты из серусодержащего сырья включает несколько химических процессов, в которых происходит изменение степени окисления сырья и промежуточных продуктов. Это может быть представлено в виде следующей схемы:

– стадия получения печного газа (оксида серы (4)),
– стадия каталитического окисления оксида серы (4) до оксида серы (6) и абсорбции его (переработка в серную кислоту).
В реальном производстве к этим химическим процессам добавляются процессы подготовки сырья, очистки печного газа, и другие механические и физико-химические операции. В общем случае схема производства серной кислоты может быть выражена в следующем виде:
Сырье→подготовка сырья →сжигание (обжиг) сырья → Очистка печного газа → контактирование → абсорбция → контактированного газа → серная кислота
Конкретная технологическая схема производства зависит от вида сырья, особенностей каталитического окисления оксида (4), наличия или отсутствия стадий абсорбции оксида серы (6).
Химическая и принципиальная схема производства.
Химическая схема получения серной кислоты из колчедана включает три последовательные стадии:
Окисление дисульфида железа пиритного концентрата кислородом воздуха:
4FеS 2 +11О 2 = 2Fe 2 О 3 + 8 SO 2 ,
Каталитическое окисление оксида серы (4) избытком кислорода печного газа:
2SO 2 + О 2 = 2SO 3 ,
Абсорбцию оксида серы (6) с образованием серной кислоты:
SO 3 +Н 2 О =H 2 SO 4
По технологическому оформлению производство серной кислоты из железного колчедана является наиболее сложным процессом и состоит из нескольких последовательно проводимых стадий.
Принципиальная схема этого производства представлена на рисунке.
1 – получение обжигового газа: 1 – обжиг колчедана, 2 – охлаждение газа в котле-утилизаторе, 3 – общая очистка газа, 4 – специальная очистка газа; 11 – контактирование: 5 – подогрев газа в теплообменнике, 6 – контактирование; 111 – абсорбция: 7 – абсорбция оксида серы (6) и образование серной кислоты.

Сернистый ангидрид S0 2 – это бесцветный газ, в 2.3 раза тяжелее воздуха, с резким запахом. При растворении в воде образуется слабая и нестойкая сернистая кислота SO 2 +Н 2 О = H 2 SO 3 .
Рассмотрим производство сернистого газа обжигом основного сырья – колчедана и затем сжиганием серы.
Окислительный обжиг колчедана .
Обжиг колчедана в токе воздуха представляет необратимый некаталитический гетерогенный процесс, протекающий с выделением тепла через стадии термической диссоциации дисульфида железа: 2FеS 2 = 2FеS+ S 2 и окисления продуктов диссоциации: S 2 +2О 2 = 2SO 2 , 4FеS +70 2 = 2Fе 2 О 3 +4 SO 2 , что описывается общим уравнением:
4FеS 2 + 11 О 2 = 2Fе 2 0 3 + 8SO 2 + ДH,
где ДH = 3400 кДж.
Скорость процесса окислительного обжига выражается общим для гетерогенных процессов уравнением:
U = dm/ dф = K m FДС.
где: К м – коэффициент массопередачи.
F – поверхность контакта фаз (катализатора),
ДС – движущая сила процесса.
Таким образом, скорость процесса обжига зависит от температуры (через Км), дисперсности обжигаемого колчедана (через F), концентрации дисульфида железа в колчедане и концентрации кислорода в воздухе (через ДС).
На рисунке представлена зависимость скорости обжига колчедана от температуры (а) и размеров частиц обжигаемого колчедана (б).

Увеличение движущей силы процесса обжига достигается флотацией колчедана, повышающей содержание дисульфида железа в сырье, обогащением воздуха кислородом и применением избытка воздуха при обжиге до 30 % сверх стехиометрического количества. На практике обжиг ведут при температуре не выше 1000 °С. т. к. за этим пределом начинается спекание частиц.
В качестве реакторов для обжига колчедана могут применяться печи различной конструкции: механические, пылевидного обжига, кипящего слоя (КС). Печи кипящего слоя отличаются высокой интенсивностью (до 10000 кг/м 2 *сут), обеспечивают более полное выгорание дисульфида железа. Недостаток – повышенное содержание пыли в газе обжига, что затрудняет его очистку.
В н. в. печи КС полностью вытеснили печи других типов в производстве серной кислоты из колчедана.
Продукты окислительного обжига колчедана – обжиговый газ и огарок, состоящий из оксида железа (3), пустой породы и невыгоревшего остатка дисульфида железа. В состав обжигового газа входят оксид серы (4), кислород, азот и незначительное количество оксида серы (6), образовавшегося за счет каталитического действия оксида железа(3). На практике печной газ содержит 13-14% оксида серы (4), 2% кислорода, и около 0.1% оксида серы (6). Т.к. в печном газе должен быть избыток кислорода для последующего окисления оксида серы (4), его состав корректируют, разбавляя воздухом до содержания оксида серы(4) 7–9% и кислорода 9–11%.
Обжиговый газ необходимо очистить от пыли, сернокислотного тумана и веществ, являющихся каталитическими ядами или представляющими ценность как побочные продукты. В обжиговом газе содержится до 300 г./м 3 пыли, которая на стадии контактирования засоряет аппаратуру и снижает активность катализатора, а также туман серной кислоты.
Пыль и сернокислотный туман удаляют из обжигового газа в процессе общей очистки газа, которая включает операции механической (грубой) и электрической тонкой) очистки. Механическую очистку газа осуществляют пропусканием газа через центробежные пылеуловители (циклоны) и волокнистые фильтры, снижающие содержание пыли в газе до 10–20 г./м 3 . После общей очистки обжиговый газ, полученный из колчедана, обязательно подвергается специальной очистке для удаления остатков пыли и тумана и, главным образом, соединений мышьяка и селена, которые при этом утилизируются. В специальную очистку газа входят операции охлаждения его до температуры ниже температур плавления оксида мышьяка и селена в башнях, орошаемых последовательно 50% и 20% серной кислотой, удаления сернокислотного тумана в мокрых электрофильтрах и завершающей осушки газа в скрубберах, орошаемых последовательно 95% серной кислотой. Из системы специальной очистки газ выходит с температурой 140 0 С.
Контактным способом производится большое количество серной кислоты, в том числе оллеум.
Контактный способ включает три стадии: 1) очистку газа от вредных для катализатора примесей; 2) контактное окислением сернистого ангидрида в серный; 3) абсорбцию серного ангидрида серной кислотой. Главной стадией является контактное окисление SO 2 в SO 3 .
Контактное окисление оксида серы (4)
Реакция окисления оксида серы (4) до оксида серы (6), лежащая в основе процесса контактирования обжигового газа, представляет собой гетерогенно-каталитическую, обратимую, экзотермическую реакцию и описывается общим уравнением: SO 2 + 0.5 О 2 →SO 3 + ДН.
Тепловой эффект реакции зависит от температуры. Система «SO2 – О2 – SO3» характеризуется состоянием равновесия в ней и скоростью процесса окисления оксида серы (4), от которых зависит суммарный результат процесса.
Константа равновесия реакции окисления оксида серы (4) равна:
К р = р8О3 / р8О2 *PO2 ,
где: рэО3, р8О2. рО2 – равновесные парциальные давления оксида серы (6), оксида серы (4), и кислорода соответственно.
Степень превращения оксида серы (4) в оксид серы (6) или степень контактирования, достигаемая на катализаторе, зависит от активности катализатора, температуры, давления, состава контактируемого газа и времени контактирования и описывается уравнением:
Где: р S 03 , где р S 03 и р S 02 – те же величины, что и в предыдущем уравнении.
Энергия активации реакции окисления оксида серы (4) кислородом в оксид серы (6) весьма велика. Поэтому в отсутствии катализатора реакция окисления даже при высокой температуре не идет. Применение катализатора позволяет снизить энергию активации реакции и увеличить скорость окисления.
В производстве серной кислоты в качестве катализатора применяют контактные массы на основе оксида ванадия (5) марок БАВ и СВД, названные так по начальным буквам элементов, входящих в их состав:
БАВ (барий, алюминий, ванадий) состава:
V 2 0 5 (7 %) + K 2 S0 4 + ВаS0 4 + Al 2 (S0 4) 3 + Si0 2 (кремнезем)

Предполагается, что процесс окисления оксида серы (4) на этих катализаторах идет через стадию диффузии реагентов к поверхности катализатора, на которой образован комплекс оксида ванадия (5) с активатором, сорбции реагентов на катализаторе с последующей десорбцией продукта реакции (оксида серы(6)):
V 2 0 5 + S0 2 = V 2 0 4 + S0 3 , V 2 0 4 + 0.50 2 = V 2 0 5 .
Температура зажигания контактных ванадиевых масс составляет 380–420 о С и зависит от состава контактируемого газа, повышаясь с уменьшением содержания в нем кислорода. Обеспечение высокой температуры в начале процесса окисления требует больших затрат энергии на подогрев газа, поступающего на контактирование. Поэтому на практике температуру газа на входе в контактный аппарат, поступающего на первый слой катализатора, задают несколько выше температуры зажигания (420 0 С). В ходе реакции выделяется большое количество тепла и так как процесс в слое катализатора идет без отвода тепла, то температура газа повышается, после этого газ охлаждается в теплообменнике и направляется на второй слой катализатора, затем снова охлаждают и т.д. Таким образом, противоречие между кинетикой и термодинамикой процесса окисления оксида серы (4)
достаточно успешно снимается конструкцией и температурным режимом работы контактного аппарата на стадии, каждая из которых отвечает оптимальным условиям протекания процесса контактирования: температура 400 0 С, давление 0.1 Мпа, содержание оксида серы (4) в газе 0.07 об. долей, содержание кислорода в газе 0.22 об. долей.
Реакторы или контактные аппараты для каталитического окисления оксида серы по своей конструкции делятся на аппараты с неподвижным слоем катализатора (полочные, фильтрующие), в которых контактная масса расположена в 4–5 слоях и аппараты кипящего слоя. Отвод тепла после прохождения газом каждого слоя катализатора осуществляется путем введения в аппарат холодного газа или воздуха, или с помощью встроенных в аппарат или вынесенных отдельно теплообменников. Совокупность контактного аппарата, теплообменников и газопроводов представляет контактный узел.
Для увеличения конечной степени контактирования применяют метод двойного контактирования и ведут процесс окисления оксида серы в две стадии. На первой стадии контактирование ведут до степени превращения не превышающей 0.90–0.91 дол. единицы, после чего из контактированного газа выделяют оксид серы (6). Затем проводят вторую стадию контактирования до степени превращения оставшегося в газе оксида серы (4) 0.95 дол. единицы. Метод двойного контактирования позволяет повысить степень контактирования до 0.995 дол. ед. и на несколько порядков снизить выброс оксида серы (4) в атмосферу.
Абсорбция оксида серы.
Последней стадией в производстве серной кислоты контактным способом является абсорбция оксида серы (6) из контактированного газа и превращение его в серную кислоту или олеум.
Абсорбция оксида серы (4) представляет обратимую экзотермическую реакцию и описывается уравнением:
nSO 3 + Н 2 О → H 2 SO 4 + (n -1) SO 3 + ДН
В зависимости от количественного соотношения оксида серы (6) и воды может быть получен продукт различной концентрации: при n >2 олеум, при n =1 моногидрат (100 % серная кислота), при n
Наилучшей поглощающей способностью обладает азеотроп серной кислоты концентрацией 98.3%. Использование кислоты более низкой концентрации приводит к интенсивному образованию тумана, а применение олеума к снижению степени абсорбции. Абсорбция оксида серы сопровождается выделением значительного количества тепла. Поэтому для обеспечения полноты поглощения оксида серы (6) процесс ведут при охлаждении газа и используют аппараты с большим абсорбционным объемом, обеспечивающие интенсивный отвод тепла. С этой же целью процесс абсорбции ведут в две стадии, используя на первой в качестве сорбента 20%-ный олеум, а на второй 98.3-ную кислоту.
Технологическая схема производства серной кислоты контактным методом. В н. в. в производстве серной кислоты контактным методом наиболее распространенной является схема с использованием принципа двойного контактирования «ДК-ДА» (двойное контактирование – двойная абсорбция). Производительность установки до 1500 т/сут. Расходные коэффициенты: колчедан 0.82 т, вода 50 м 3 , электроэнергия 82 кВт*ч
Сжигание серыпроисходит значительно проще и легче, чем обжиг колчедан. Технологический процесс производства серной кислоты из элементарной серы отличается от процесса производства из колчедана следующими особенностями:
· особая конструкция печей для получения печного газа;
· повышенное содержание оксида серы (4) в печном газе;
· отсутствие стадии предварительной очистки печного газа.
Принципиальная схема производства серной кислоты из серы представлена на рисунке:

1 – осушка воздуха, 2 – сжигание серы, 3 – охлаждение газа,
4 – контактирование, 5 – абсорбция оксида серы (6).
Фактически сера перед горением плавится и испаряется и сгорает в газовой фазе. Горение серы представляет гомогенную экзотермическую реакцию, которой предшествует процесс перехода твердой серы в жидкое состояние и ее последующее испарение:
Таким образом, процесс горения протекает в газовой фазе в потоке предварительно высушенного воздуха и описывается уравнением:
S + О 2 = SO 2 + ДH
Для сжигания чистой серы применяют форсуночные и циклонные печи. Перед подачей в печь серу плавят в плавильном котле глухим паром, отфильтровывают от примесей и распыляют сжатым воздухом через форсунку в печи; при этом сера испаряется и сгорает. В форсуночной печи перешивание серы с воздухом недостаточное, тормозится процесс диффузией и происходит экстенсивно. В циклонной печи благодаря тангенциальному подводу воздуха происходит исключительно сильное перешивание паров серы с воздухом и интенсивность сгорания увеличивается.
Печной газ при сжигании серы отличается более высоким содержанием оксида серы (4) и не содержит значительного количества пыли. При сжигании самородной серы в нем также отсутствуют соединения мышьяка и селена, являющимися каталитическими ядами.
Товарные сорта серной кислоты
Современная промышленность выпускает несколько сортов серной кислоты и олеума, различающихся концентрацией и чистотой. Чтобы уменьшить возможность кристаллизации продуктов при перевозке и хранении, а также в самом производстве, установлены стандарты на товарные сорта, концентрации которых отвечают эвтектическим составам с наиболее низкими
| Сорт продукта | Содержание св. SO3, % |
Температура, 0 С |
|
| Башенная к-та | 75 | 0.0 | -29.5 |
| Контактная к-та | 92.5 | 0.0 | -22 |
| олеум | 104.5 | 20 | +2.0 |
| Высокопроцент. | 114.6 | 65 | -0.35 |
Среди минеральных кисло, производимых химической промышленностью, серная кислота по объему производства и потребления занимаетпервое место. Ее мировое производство составляет в настоящее время ~ 150 млн. т в год. Объясняется это тем, что серная кислота - одна из самых сильных и самая дешевая из всех кислот. Серная кислота не дымит, в концентрированном виде не разрушает черные металлы, в широком диапазоне температур (от – 40 ÷ - 20 0 С) находится в жидком состоянии.
Область применения серной кислоты чрезвычайно обширны. Существенная ее часть используется как полупродукт в различных отраслях химической промышленности, прежде всего, для получения минеральных удобрений, минеральные пигменты, минеральные кислоты HF, H 3 PO 4 , H 3 BO 4 , а также солей, кислот, взрывчатых веществ. Серная кислота применяется также при производстве: органических красителей, спиртов, кислот, эфиров, химических волокон, текстильная промышленнсть; металлургической, текстильной, пищевой промышленности. Производство патоки, глюкозы; K 2 Cr 2 O 7 и Na 2 Cr 2 O 7 ; сульфатов Na, K, Fe, Cu, Zn, Al, сульфат аммония (NH 4) 2 SO 4 ; очистка нефтепродуктов и минеральных масел; травление металлов.
Составьте химические функциональные схемы производства серной кислоты контактным способом из серы, серного колчедана и из отходов цветной металлургии.
Как влияет выбор сырья для производства серной кислоты на технологическую схему процесса? Каковы основные различия в технологических схемах получения серной кислоты из серы и из колчедана?
Исходным реагентами для получения серной кислоты могут быть элементарная сера и серосодержащие соединения, из которых можно получить либо серу, либо диоксид серы. Такими соединениями являются сульфиды железа, сульфиды цветных металлов (меди, цинка и др.), сероводород и ряд других сернистых соединений.
Традиционно основными источниками сырья является элементарная сера и железный (серный) колчедан. Значительное место (15%) в сырьевом балансе занимают отходные газы цветной металлургии, содержащие диоксид серы.
Дайте характеристику реакции сжигания серы в промышленных печах.
Сжигание серы проводят в промышленности следующим образом. Серу предварительно расплавляют (для этого можно использовать водяной пар). Так как температура плавления сыры сравнительно низка, то путем отстаивания и последующей фильтрации от серы легко отделить механические примеси, не перешедшие в жидкую фазу, и получить исходное сырье достаточной степени чистоты. Для сжигания расплавленной серы используют два типа речей – форсуночные и циклонные. В них необходимо предусмотреть распыленние жидкой серы для ее быстрого испарения и обеспечения надежного контакта с воздухом во всех частях аппарата.
Каковы основные элементы конструкции печей для сжигания серы? Как в них обеспечивается необходимый технологический режим?
Циклонная печь для сжигания серы. Она состоит из двух горизонтальных цилиндров – форкамеры и двух камер дожигания. Печь имеет воздушный короб (рубашка) для снижения температуры наружной обшивки печи и предупреждения утечки диоксида серы. В форкамере через две группы сопел тангенциально подают воздух; через форсунку механического типа также тангенциально поступает расплавленная сера. Образующийся при сжигании жидкой серы обжигание газа всесте с парами серы поступает через пережимное кольцо из форкамеры в первую камеру досжигателя, в которой также расположены воздушные сопла и форсунки для подачи серы. Из первой камеры дожигания газ через пережимное кольцо поступает во вторую камеру дожигания, где сгорают остатки серы.
Обоснуйте выбор технологического режима сжигания серы.
При адиабатическом сжигании серы температура обжига для реакционной смеси стехиометрического состава состоит ~ 1500 0 С. В практических условиях возможности повышения температуры в печи ограничены тем, что выше 1300 0 С бастро разрушается футеровка печи и газоходов. Обычно при сжигании серы получают обжиговый газ, содержащий 13 – 14 % SO 2.
Обоснуйте выбор температурного режима, состава обжигового газа, конструкции реакторов на стадии контактного окисления диоксида серы в производстве серной кислоты. Дайте характеристику используемых катализаторов.
Реакция (׀׀׀) окисления диоксида серы характеризуется очень высоким значением энеггии активации и поэтому практическое ее осуществление возможно лишь в присуствии катализатора.
В промышленности основным катализатором окисления SO2 является катализатор на основе оксида ванадия V2O5. Каталитическую активность в этой реакции проявляет и другие соединения, прежде всего – платина. Однако платиновые катализаторы чрезвычайно чувствительны даже к следам мышьяка, селена, хлора и других примесей и поэтому постепенно были вытеснены ванадиевым катализатором.
Каталитическую активность проявляется также оксид железа (׀׀׀) Fe2O3, однако лишь в области высоких температур. Каталитической активностью Fe 2 O 3 , входящие в состав огарка, можно объяснить наличие в обжигомом газе, выходящим из печей КС, небольших количеств триоксида серы.
Реакция окисления диоксида серы – обратимая экзотермическая. Тепловой эффект реакции составляет при 500 0 С 94,23 кДж/моль; в зависимости от температуры он описывается уравнением ∆H r =-101420+9,26T Дж/моль.
В чем состоят преимущества схемы двойного контактирования и двойной абсорбции (ДКДА) перед схемами с одинарным контактированием? За счет чего достигается увеличение степени превращения диоксида серы при проведении процесса по схеме ДКДА?
Почему оптимальным абсорбентом для поглощения триоксида серы является серная кислота концентрацией 98,3%?
Последней стадией процесса производства серной кислоты контактным способом является абсорбция триоксида серы из газовой смеси и превращение его в серную кислоту. При выборе абсорбента и условий проведения стадии абсорбции необходимо обеспечивать почти 100%-ное извлечение SO 3 из газовой фазы. Для полного извлечения SO 3 необходимо, чтобы равновесное парциональное давление SO 3 над растворителем было ничтожно малым, так как при этом будет велика движущая сила процесса абсорбции. С другой стороны, в качестве абсорбента нельзя использовать такие растворы, над поверхностью которых велико равновестное парциальное давление паров воды. В этом случае еще не растворенные молекулы SO 3 , будут реагировать с молекулами воды в паровой фазе с образованием паров серной кислоты. Они быстро конденсируются в объеме с образованием мельчайших капель серной кислоты, диспергированных в инертной газовой среде – азоте, т. е. с образованием сернокислотного тумана:
Туман плохо улавливается в обычной абсорбционной аппаратуре и в основном уносится с отходящими газами в атмосферу, при этом загрезняется ОС и возростают потери серной кислоты.
Высказанные соображения позволяют решить вопрос о выборе абсорбента. Диаграмма фазового равновесия пар – жидкость для системы показывает, что оптимальным абсорбентом является 98,3%-ная серная кислота (техническая название – моногидрат), соответствующая азеотропному составу. Действительно, над этой кислотой практически нет ни паров воды, ни паров SO 3 . Протекающий при этом процесс можно условно описать уравнением реакции:
Почему в схемах получения серной кислоты, где одним из продуктов является олеум, после олеумного абсорбера расположен моногидратный абсорбер?
Использование в качестве поглотителя серной кислоты с концентрацией ниже 98,3% может привести к образованию сернокислотного тумана, а над 100%-ной серной кислотой или олеумом в паровой фазе значительно равновесное парциальное давление SO 3 , поэтому он будет абсорбироваться не полностью. Однако если в качестве одного из продуктов процесса необходимо получить олеум, можно совместить абсорбцию олеумом (1–й абсорбер) и абсорбцию 98,3%-ной кислотой (2–й абсорбер).
Над 98,3%-ной кислотой, может быть значительное парциальное давление паров самой кислоты. Что также снижает степень абсорбции SO 3. Но при температурах ниже 100 0 С равновесное давление паров H 2 SO 4 очень мало и может быть достигнута практически 100% - ная степень абсорбции (степень абсорбции SO 3 в моногидратном обсорбире при различных температурах: при 60 0 С, 80 0 С, 100 0 С,120 0 С).
Дайте характеристику реакциям обжига колчедана. Обоснуйте выбор температурного режима обжига колчедана.
кДж/моль, или 7117 кДж/кг. Фактически она протекает через несколько последовательно - паралельных стадий. Сначала происходит медленная эндотермическая реакция термического разложения дисульфата железа, а затем начинаются сильно энзотермичаские реакции горения паров серы и окисления сульфата железа FeS.
Часть кислорода воздуха расходуется в реакции на окисление железа и поэтому максимально возможная концентрация диоксида серы в обжиговом газе в этом случае ниже, чем при сжигании серы. В воздухе на каждый моль кислорода приходится 79/21 молей азота и инертов.
Температура процесса должна быть достаточно большой для обеспечения высокой скорости реакции. При низких температурах (ниже 500 0 С) не сможет протекать эндотермическая реакция термического разложения дисульфита железа. С другой стороны, проведение процесса при очень высоких температурах может вызвать нежелательный физический процесс спекания частиц горящего материала, приводящий к увеличению их размеров. Следствием этого явится увеличение времени полного превращения твердых частиц и понижение производительности печи. Температура спекания колеблется в зависимости от состава (сорта) колчедана в пределах от 800 0 С до 900 0 С.
В чем преимущества печей кипящего слоя (КС) при осуществлении процесса обжига колчедана перед другими типами печей? Как в этих печах регулируют температуру обжига?
В настоящее время в сернокислотной промышленности для обжига колчндана применяют в основном печи КС с псевдоожиженным слоем твердого материала. В псевдоожиженном слое обеспечиваются высокая скорость диффузионных и теплообменных процессов (подвод кислорода к поверхности колчедана, отвод диоксида серы в газовый поток, отвод теплоты от поверхности сырья к газовому потоку). Отсуствие тормозящего влияния массо - и теплообменных процессов позволяет проводить обжиг колчедана с высокой скоростью. Печи КС характеризуются максимальной интенсивностью в сравнении с другими конструкциями, применяемами для обжига колчедана. К недостаткам печей КС можно отнести высркую зыпыленность обжигового газа.
Проведение процесса в адиабатическом режиме привела бы к созданию более высоких температур. Поэтому часть теплоты обжига приходится отводить внутри печи. Удобнее всего это сделать в печах КС, так как в псевдоожиженном слое твердого материала достаточно велик коэффициент теплоотдачи от колчедана к поверхности охлаждающих элементов [~1000 кДж/(м 2 ·ч·К)] и в «кипящий» слой можно ввести змеевики охлаждения.
Какие задачи решаются на стадиях сухой и мокрой очистки обжигового газа? Каковы физико-химические основы стадии очистки? Оборудование для очистки.
Подготовка обжигового газа к контактному окислению заключается в удалении из него примесей, присутствие которых может вызвать затруднения при проведении последующих стадий, а также нагрев (или охлаждение) до температуры, при которой начинается контактное окисление.
Обжиговый газ, полученный сжиганием колчедана в печах КС, содержит большое количество огарковой пыли, соединения мышьяка, селена и фтора. Очистка обжигового газа начинается в печном отделении, где в циклонах и сухих электрофильтрах осаждают огарковую пыль. Содержание пыли в газе после сухой очистки не должнопревышать 50 мг/м 3 . Последующая очистка осуществляется на стадии мокрой очистки в промывном отделении. При этом из обжигового газа удаляют остатка пыли, каталитические яды (соединения мышьяка и фтора), а также соединения селена.
Наличие в газе пыли, даже в небольших количествах оставшейся после сухой очистки, может привести к повышению гидравлического сопротивления аппаратов и отравлению катализатора соединениями As, адсорбированными на огарковой пыли. Отравление катализатора произойдет и в том случае, если в газовой фазе останутся оксиды мышьяка As 2 O 3 или соединения фтора (HF и SiF 4). Диоксид селена SeO 2 не являются ядом для катализатора контактного окисления, однако он представляет собой ценное исходное сырье для промышленности полупроводников.
Мокрая очистка обжигового газа заключается в промывке его разбавленной серной кислотой. При этом происходит ряд физических процессов: конденсация, абсорбция и т. п.
Какие можно предложить методы снижения содержания в отходящих газах установок получения серной кислоты?
Каковы технико-экономические характеристики производства серной кислоты?
В чем состоит отличие технологической схемы производства серной кислоты на Бийском олеумном заводе от классических схем?
Охрана окружающей среды при производстве серной кислоты.
Увеличение единичной мощности агрегатов по производству серной кислоты и удобрений может привести к загрязнению ОС даже при сравнительно невысоких концентрациях вредных выбросов. Поэтому основной тенденцией в развитии технологических процессов является создание замкнутых малоотходных или безотходных схем, сокращение до минимума сброса вредных веществ в атмосферу и в сточные воды.
Для очистки от триоксида серы, а особенно от серной кислоты в форме аэрозоля (тумана) отходящие газы пропускают через брызгоуловители и специальные фильтры. При необходимости на выхлопе сернокислотной системы предусматривают электрофильтры. Сточные воды сернокислотного производства должны быть подвергнуты тщательной очистке от соединений мышьяка.
Серная кислота нашла широкое применение в различных отраслях человеческой деятельности. Современная химическая промышленность включает её в перечень основных продуктов производства, уровень её выпуска является косвенным показателем потенциала химического производства отдельной страны. Ежегодно в мире производится около 160 миллионов тонн этого вещества.
По своим физико-химическим свойствам серная кислота является двухосновной кислотой, в этом достигает самой высокой степени окисления (+6). В обычных условиях в концентрированном состоянии серная кислота представляет собой тяжёлую маслянистую жидкость, не имеющую ни цвета, ни запаха. Используется серная кислота в растворе. В качестве растворителя может использоваться как обычная вода, так и серный ангидрид. Принято считать раствор водным, если отношение количество молекул серного ангидрида к количеству воды меньше единицы. При превышении этого показателя применяют выражение - раствор серного ангидрида в серной кислоте или олеум.
Производство серной кислоты обеспечивает этим ценным продуктом технологический процесс создания минеральных удобрений, её используют в качестве электролита в является основным компонентом при получении различных минеральных солей и кислот. Химические волокна, красители, дымообразующие и в технологии своего производства используют серную кислоту. Без нее невозможно представить себе нефтяную, металлообрабатывающую, текстильную, кожевенную и другие
Даже пищевая отрасль не обошлась без использования этого вещества - получение пищевой добавки E513(эмульгатора). Промышленный органический синтез, дегидратация (процесс получения сложных эфиров, диэтилового эфира), гидратация (добыча этанола из этилена), сульфирование (производство и промежуточных продуктов при получении красителей), алкилирование (синтез изооктана, капролактама, полиэтиленгликоля), восстановление смол в фильтрах на линиях производства дистиллированной воды - ни один из этих процессов не обходится без использования серной кислоты.
Производство серной кислоты обеспечивает самого основного потребителя этого вещества - синтез минеральных удобрений. К примеру, для получения тонны необходимо израсходовать от двух до трёх с половиной тонн серной кислоты. По этой причине сернокислотные предприятия, на которые возложено производство серной кислоты, строят в комплексе с заводами производящими
Для добычи серной кислоты используются два технологических метода. Производство серной кислоты контактным способом является основным и составляет девяносто процентов, нитрозный (башенный) метод получил меньшую распространённость. Несмотря на недостатки и достоинства каждого, производство серной кислоты из колчедана вытеснило нитрозный благодаря более привлекательным показателям себестоимости, чистотой и высокой концентрацией готового продукта на выходе.
Освоение сернокислотными заводами контактного способа синтеза, производство серной кислоты позволяет разбить на три этапа. На первой стадии происходит обжиг пирита, для этого используются специальные печи обжига в так называемом "кипящем слое". Вторая стадия предполагает окисление серного газа до оксида серы (VI), и на третьей стадии происходит получение олеума, который разливают по цистернам и отправляют заказчикам.
Производство серной кислоты нитрозным способом не нашло широкого использования из-за недостаточной чистоты выходного продукта, что ограничивает его применение.
Вне зависимости от методов и способов получения, производство серной кислоты требует от производственников уделять повышенное внимание охране окружающей среды.

